高中化学必修2知识点大全总结「高中化学必修2知识点大全」
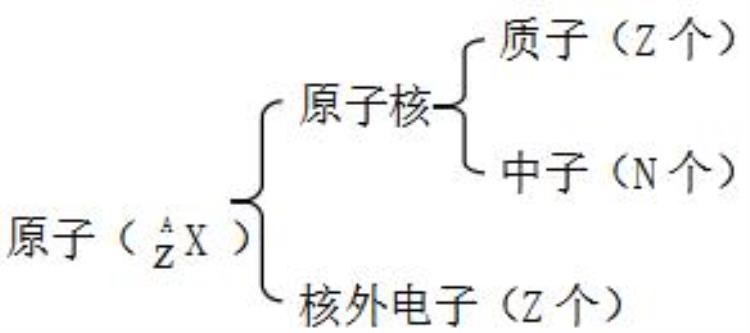
一、原子结构
注意:质量数(A)=质子数(Z)+中子数(N)
原子序数=核电荷数=质子数=原子的核外电子数
熟背前20号元素,熟悉1~20号元素原子核外电子的排布:
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca
2.原子核外电子的排布规律:
①电子总是尽先排布在能量最低的电子层里;
②各电子层最多容纳的电子数是2n2;

第一章 物质结构 元素周期律

一、原子结构
注意:质量数(A)=质子数(Z)+中子数(N)
原子序数=核电荷数=质子数=原子的核外电子数
熟背前20号元素,熟悉1~20号元素原子核外电子的排布:
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca
2.原子核外电子的排布规律:
①电子总是尽先排布在能量最低的电子层里;
②各电子层最多容纳的电子数是2n2;
③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
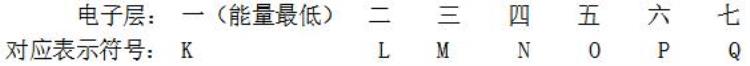
3.元素、核素、同位素
元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。(对于原子来说)
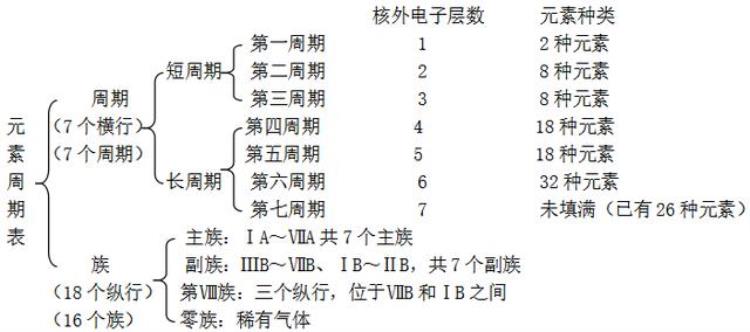
二、元素周期表
1.编排原则:
①按原子序数递增的顺序从左到右排列
②将电子层数相同的各元素从左到右排成一横行。(周期序数=原子的电子层数)
③把最外层电子数相同的元素按电子层数递增的顺序从上到下排成一纵行。
主族序数=原子最外层电子数
2.结构特点:
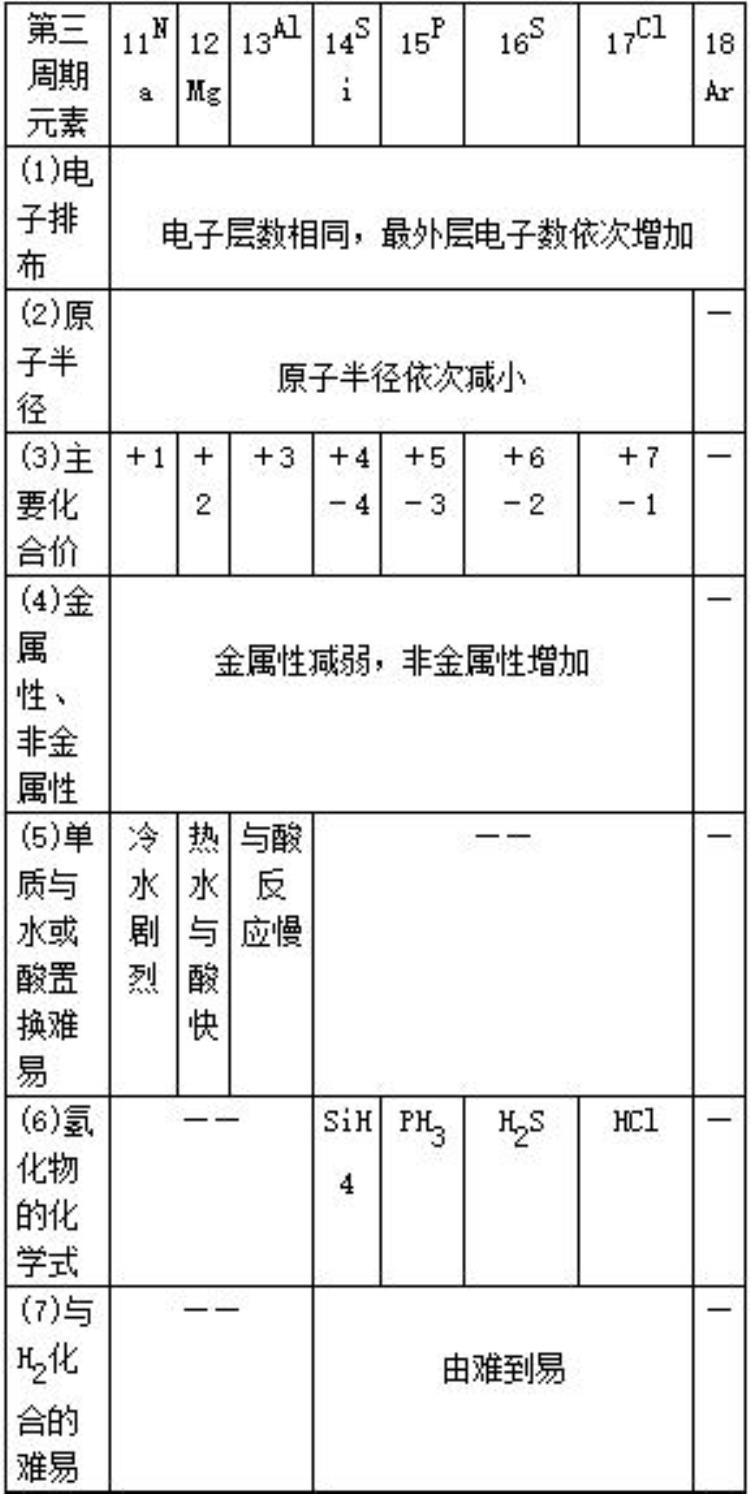
三、元素周期律
1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。元素性质的周期性变化实质是元素原子核外电子排布的周期性变化的必然结果。
2.同周期元素性质递变规律
第ⅠA族碱金属元素:Li Na K Rb Cs Fr(Fr是金属性最强的元素,位于周期表左下方)
第ⅦA族卤族元素:F Cl Br I At(F是非金属性最强的元素,位于周期表右上方)
判断元素金属性和非金属性强弱的方法:
(1)金属性强(弱)——①单质与水或酸反应生成氢气容易(难);②氢氧化物碱性强(弱);③相互置换反应(强制弱)Fe+CuSO4=FeSO4+Cu。
(2)非金属性强(弱)——①单质与氢气易(难)反应;②生成的氢化物稳定(不稳定);③最高价氧化物的水化物(含氧酸)酸性强(弱);④相互置换反应(强制弱)2NaBr+Cl2=2NaCl+Br2。
同周期比较:
金属性:Na>Mg>Al
与酸或水反应:从易→难
碱性:NaOH>Mg(OH)2>Al(OH)3
非金属性:Si<P<S<Cl
单质与氢气反应:从难→易
氢化物稳定性:SiH4<PH3<H2S<HCl
酸性(含氧酸):H2SiO3<H3PO4<H2SO4<HClO4
同主族比较:
金属性:Li<Na<K<Rb<Cs(碱金属元素)
与酸或水反应:从难→易
碱性:LiOH<NaOH<KOH<RbOH<CsOH
非金属性:F>Cl>Br>I(卤族元素)
单质与氢气反应:从易→难
氢化物稳定:HF>HCl>HBr>HI
金属性:Li<Na<K<Rb<Cs
还原性(失电子能力):Li<Na<K<Rb<Cs
氧化性(得电子能力):Li+>Na+>K+>Rb+>Cs+
非金属性:F>Cl>Br>I
氧化性:F2>Cl2>Br2>I2
还原性:F-<Cl-<Br-<I-
酸性(无氧酸):HF<HCl<HBr<HI
比较粒子(包括原子、离子)半径的方法:
(1)先比较电子层数,电子层数多的半径大。
(2)电子层数相同时,再比较核电荷数,核电荷数多的半径反而小。
四、化学键
化学键是相邻两个或多个原子间强烈的相互作用。
1.离子键与共价键的比较
键型
离子键
共价键
概念
阴阳离子结合成化合物的静电作用叫离子键
原子之间通过共用电子对所形成的相互作用叫做共价键
成键方式
通过得失电子达到稳定结构
通过形成共用电子对达到稳定结构
成键粒子
阴、阳离子
原子
成键元素
活泼金属与活泼非金属元素之间(特殊:NH4Cl、NH4NO3等铵盐只由非金属元素组成,但含有离子键)
非金属元素之间
离子化合物:由离子键构成的化合物叫做离子化合物。(一定有离子键,可能有共价键)
共价化合物:原子间通过共用电子对形成分子的化合物叫做共价化合物。(只有共价键)

2.电子式:
用电子式表示离子键形成的物质的结构与表示共价键形成的物质的结构的不同点:
(1)电荷:用电子式表示离子键形成的物质的结构需标出阳离子和阴离子的电荷;而表示共价键形成的物质的结构不能标电荷。
(2)[ ](方括号):离子键形成的物质中的阴离子需用方括号括起来,而共价键形成的物质中不能用方括号。
第二章 化学反应与能量

第一节 化学能与热能
1、在任何的化学反应中总伴有能量的变化。
原因:当物质发生化学反应时,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量。化学键的断裂和形成是化学反应中能量变化的主要原因。
一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于反应物的总能量与生成物的总能量的相对大小。E反应物总能量>E生成物总能量,为放热反应。E反应物总能量<E生成物总能量,为吸热反应。
2、常见的放热反应和吸热反应
常见的放热反应:
①所有的燃烧与缓慢氧化。
②酸碱中和反应。
③金属与酸反应制取氢气。
④大多数化合反应(特殊:
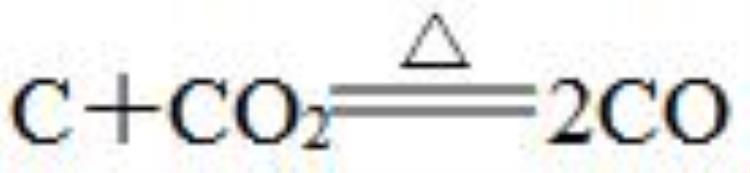
是吸热反应)。
常见的吸热反应:
①以C、H2、CO为还原剂的氧化还原反应如:
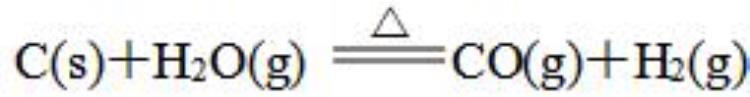
②铵盐和碱的反应如Ba(OH)2·8H2O+NH4Cl=BaCl2+2NH3↑+10H2O
③大多数分解反应如KClO3、KMnO4、CaCO3的分解等。
3、能源的分类:
形成条件
利用历史
性质
一次能源
常规能源
可再生资源
水能、风能、生物质能
不可再生资源
煤、石油、天然气等化石能源
新能源
可再生资源
太阳能、风能、地热能、潮汐能、氢能、沼气
不可再生资源
核能
二次能源
(一次能源经过加工、转化得到的能源称为二次能源)
电能(水电、火电、核电)、蒸汽、工业余热、酒精、汽油、焦炭等
【思考】一般说来,大多数化合反应是放热反应,大多数分解反应是吸热反应,放热反应都不需要加热,吸热反应都需要加热,这种说法对吗?试举例说明。
点拔:这种说法不对。如C+O2=CO2的反应是放热反应,但需要加热,只是反应开始后不再需要加热,反应放出的热量可以使反应继续下去。Ba(OH)2·8H2O与NH4Cl的反应是吸热反应,但反应并不需要加热。
第二节 化学能与电能
1、化学能转化为电能的方式:
电能
(电力)
火电(火力发电)
化学能→热能→机械能→电能
缺点:环境污染、低效
原电池
将化学能直接转化为电能
优点:清洁、高效
2、原电池原理
(1)概念:把化学能直接转化为电能的装置叫做原电池。
(2)原电池的工作原理:通过氧化还原反应(有电子的转移)把化学能转变为电能。
(3)构成原电池的条件:
①电极为导体且活泼性不同;
②两个电极接触(导线连接或直接接触);
③两个相互连接的电极插入电解质溶液构成闭合回路。
(4)电极名称及发生的反应:
负极:
较活泼的金属作负极,负极发生氧化反应
电极反应式:较活泼金属-ne-=金属阳离子
负极现象:负极溶解,负极质量减少
正极:
较不活泼的金属或石墨作正极,正极发生还原反应
电极反应式:溶液中阳离子+ne-=单质
正极的现象:一般有气体放出或正极质量增加
(5)原电池正负极的判断方法:
①依据原电池两极的材料:
较活泼的金属作负极(K、Ca、Na太活泼,不能作电极);
较不活泼金属或可导电非金属(石墨)、氧化物(MnO2)等作正极。
②根据电流方向或电子流向:(外电路)的电流由正极流向负极;电子则由负极经外电路流向原电池的正极。
③根据内电路离子的迁移方向:阳离子流向原电池正极,阴离子流向原电池负极。
④根据原电池中的反应类型:
负极:失电子,发生氧化反应,现象通常是电极本身消耗,质量减小。
正极:得电子,发生还原反应,现象是常伴随金属的析出或H2的放出。
(6)原电池电极反应的书写方法:
①原电池反应所依托的化学反应原理是氧化还原反应,负极反应是氧化反应,正极反应是还原反应。因此书写电极反应的方法归纳如下:
写出总反应方程式;
把总反应根据电子得失情况,分成氧化反应、还原反应;
氧化反应在负极发生,还原反应在正极发生,反应物和生成物对号入座,注意酸碱介质和水等参与反应。
②原电池的总反应式一般把正极和负极反应式相加而得。
(7)原电池的应用:
①加快化学反应速率,如粗锌制氢气速率比纯锌制氢气快。
②比较金属活动性强弱。
③设计原电池。
④金属的腐蚀。
3、化学电源基本类型:
①干电池:活泼金属作负极,被腐蚀或消耗。如:Cu-Zn原电池、锌锰电池。
②充电电池:两极都参加反应的原电池,可充电循环使用。如铅蓄电池、锂电池和银锌电池等。
③燃料电池:两电极材料均为惰性电极,电极本身不发生反应,而是由引入到两极上的物质发生反应,如H2、CH4燃料电池,其电解质溶液常为碱性试剂(KOH等)。
第三节 化学反应的速率和限度

1、化学反应的速率
(1)概念:化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示。
计算公式:
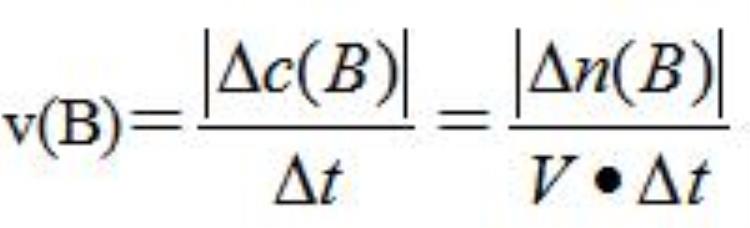
①单位:mol/(L·s)或mol/(L·min)
②B为溶液或气体,若B为固体或纯液体不计算速率。
③以上所表示的是平均速率,而不是瞬时速率。
④重要规律:
速率比=方程式系数比
变化量比=方程式系数比
(2)影响化学反应速率的因素:
内因:由参加反应的物质的结构和性质决定的(主要因素)。
外因:①温度:升高温度,增大速率
②催化剂:一般加快反应速率(正催化剂)
③浓度:增加C反应物的浓度,增大速率(溶液或气体才有浓度可言)
④压强:增大压强,增大速率(适用于有气体参加的反应)
⑤其它因素:如光(射线)、固体的表面积(颗粒大小)、反应物的状态(溶剂)、原电池等也会改变化学反应速率。
2、化学反应的限度——化学平衡
(1)在一定条件下,当一个可逆反应进行到正向反应速率与逆向反应速率相等时,反应物和生成物的浓度不再改变,达到表面上静止的一种“平衡状态”,这就是这个反应所能达到的限度,即化学平衡状态。
化学平衡的移动受到温度、反应物浓度、压强等因素的影响。催化剂只改变化学反应速率,对化学平衡无影响。
在相同的条件下同时向正、逆两个反应方向进行的反应叫做可逆反应。通常把由反应物向生成物进行的反应叫做正反应。而由生成物向反应物进行的反应叫做逆反应。
在任何可逆反应中,正方应进行的同时,逆反应也在进行。可逆反应不能进行到底,即是说可逆反应无论进行到何种程度,任何物质(反应物和生成物)的物质的量都不可能为0。
(2)化学平衡状态的特征:逆、动、等、定、变。
①逆:化学平衡研究的对象是可逆反应。
②动:动态平衡,达到平衡状态时,正逆反应仍在不断进行。
③等:达到平衡状态时,正方应速率和逆反应速率相等,但不等于0。即v正=v逆≠0。
④定:达到平衡状态时,各组分的浓度保持不变,各组成成分的含量保持一定。
⑤变:当条件变化时,原平衡被破坏,在新的条件下会重新建立新的平衡。
(3)判断化学平衡状态的标志:
①VA(正方向)=VA(逆方向)或nA(消耗)=nA(生成)(不同方向同一物质比较)
②各组分浓度保持不变或百分含量不变
③借助颜色不变判断(有一种物质是有颜色的)
④总物质的量或总体积或总压强或平均相对分子质量不变(前提:反应前后气体的总物质的量不相等的反应适用,即如对于反应
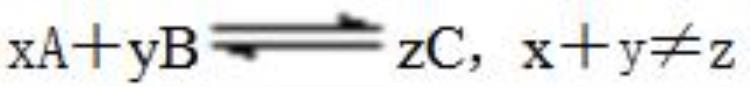
)
第三章 有机化合物

绝大多数含碳的化合物称为有机化合物,简称有机物。像CO、CO2、碳酸、碳酸盐等少数化合物,由于它们的组成和性质跟无机化合物相似,因而一向把它们作为无机化合物。
一、烃
1、烃的定义:仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃。
2、烃的分类:

3、甲烷、乙烯和苯的性质比较:
有机物
烷烃
烯烃
苯及其同系物
通式
CnH2n 2
CnH2n
——
代表物
甲烷(CH4)
乙烯(C2H4)
苯(C6H6)
结构简式
CH4
CH2=CH2
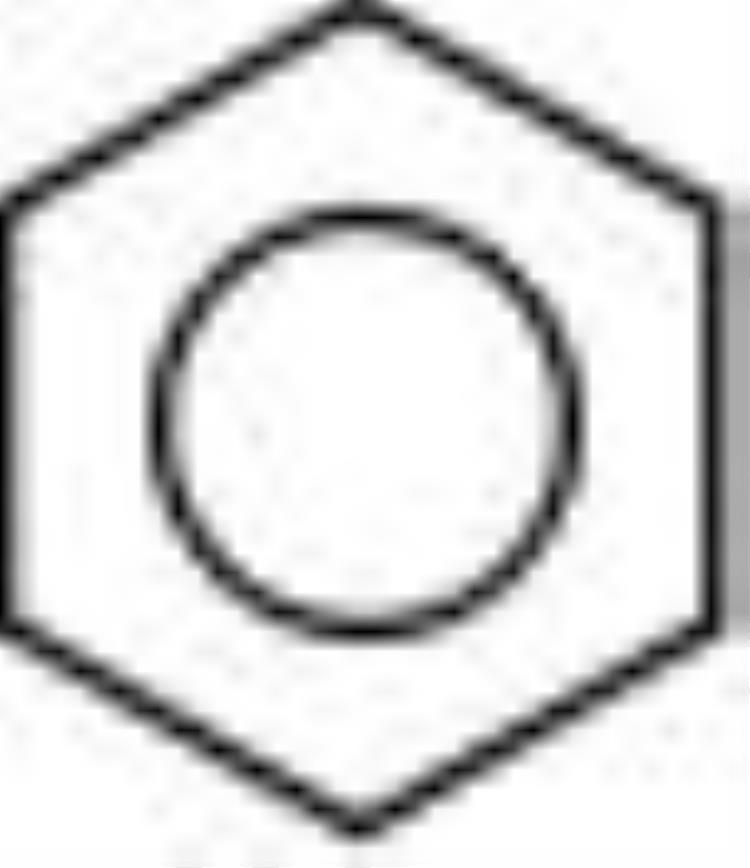
或
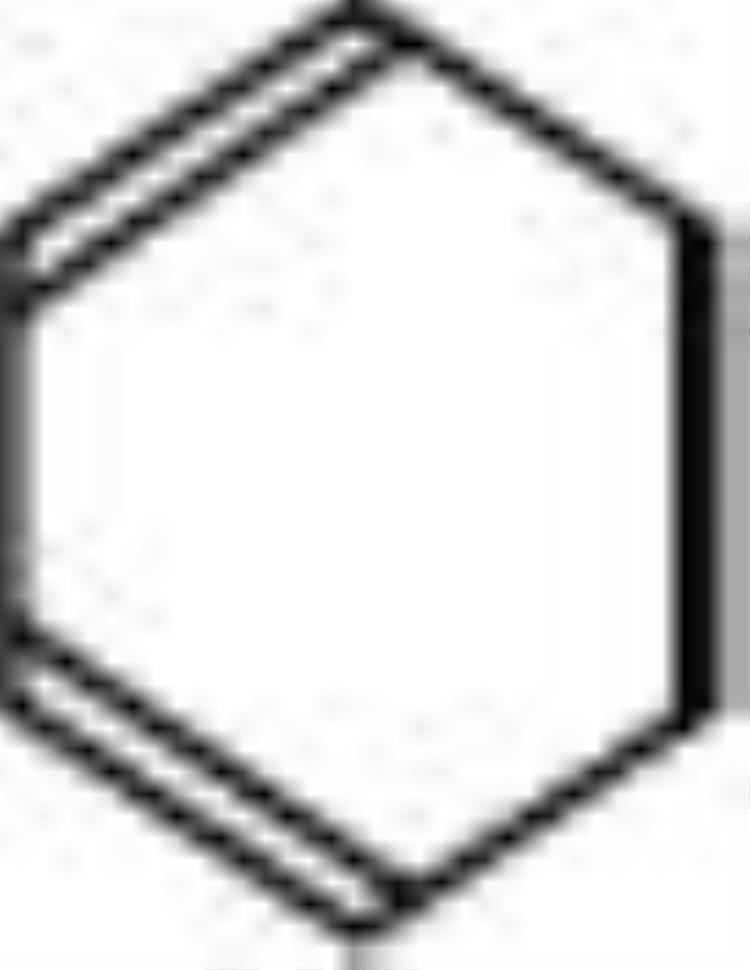
(官能团)
结构特点
C-C单键,
链状,饱和烃
C=C双键,
链状,不饱和烃
一种介于单键和双键之间的独特的键,环状
空间结构
正四面体
六原子共平面
平面正六边形
物理性质
无色无味的气体,比空气轻,难溶于水
无色稍有气味的气体,比空气略轻,难溶于水
无色有特殊气味的液体,比水轻,难溶于水
用途
优良燃料,化工原料
石化工业原料,植物生长调节剂,催熟剂
溶剂,化工原料
有机物
主 要 化 学 性 质
烷烃:
甲烷
①氧化反应(燃烧)
CH4 2O2――→CO2 2H2O(淡蓝色火焰,无黑烟)
②取代反应 (注意光是反应发生的主要原因,产物有5种)
CH4 Cl2―→CH3Cl HCl CH3Cl Cl2―→CH2Cl2 HCl
CH2Cl2 Cl2―→CHCl3 HCl CHCl3 Cl2―→CCl4 HCl
在光照条件下甲烷还可以跟溴蒸气发生取代反应,甲烷不能使酸性KMnO4溶液、溴水或溴的四氯化碳溶液褪色。
烯烃:
乙烯
①氧化反应
(ⅰ)燃烧
C2H4 3O2――→2CO2 2H2O(火焰明亮,有黑烟)
(ⅱ)被酸性KMnO4溶液氧化,能使酸性KMnO4溶液褪色。
②加成反应
CH2=CH2+Br2-→CH2Br-CH2Br(能使溴水或溴的四氯化碳溶液褪色)
在一定条件下,乙烯还可以与H2、Cl2、HCl、H2O等发生加成反应
CH2=CH2+H2――→CH3CH3
CH2=CH2+HCl-→CH3CH2Cl(氯乙烷)
CH2=CH2+H2O――→CH3CH2OH(制乙醇)
③加聚反应 nCH2=CH2――→-CH2-CH2-n(聚乙烯)
乙烯能使酸性KMnO4溶液、溴水或溴的四氯化碳溶液褪色。常利用该反应鉴别烷烃和烯烃,如鉴别甲烷和乙烯。
苯
①氧化反应(燃烧)
2C6H6+15O2―→12CO2+6H2O(火焰明亮,有浓烟)
②取代反应
苯环上的氢原子被溴原子、硝基取代。
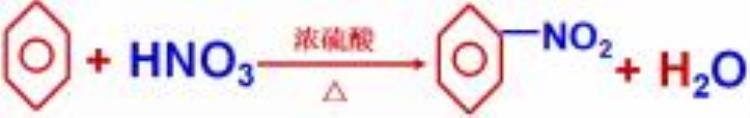
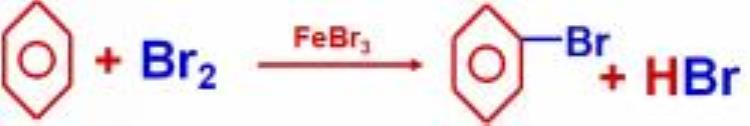
③加成反应
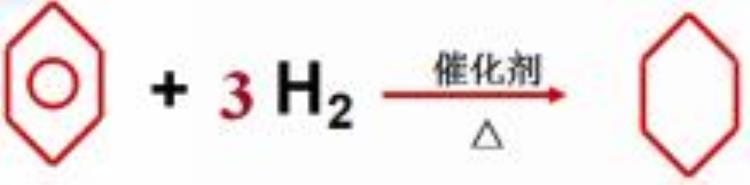
苯不能使酸性KMnO4溶液、溴水或溴的四氯化碳溶液褪色。
4、同系物、同分异构体、同素异形体、同位素比较。
概念
同系物
同分异构体
同素异形体
同位素
定义
结构相似,在分子组成上相差一个或若干个CH2原子团的物质
分子式相同而结构式不同的化合物的互称
由同种元素组成的不同单质的互称
质子数相同而中子数不同的同一元素的不同原子的互称
分子式
不同
相同
元素符号表示相同,分子式可不同
——
结构
相似
不同
不同
——
研究对象
化合物
化合物
单质
原子
5、烷烃的命名:
(1)普通命名法:把烷烃泛称为“某烷”,某是指烷烃中碳原子的数目。1-10用甲,乙,丙,丁,戊,已,庚,辛,壬,癸;11起汉文数字表示。
区别同分异构体,用“正”,“异”,“新”:正丁烷,异丁烷;正戊烷,异戊烷,新戊烷。
(2)系统命名法:
①命名步骤:
找主链-最长的碳链(确定母体名称);
编号-靠近支链(小、多)的一端;
(3)写名称-先简后繁,相同基请合并
②名称组成:取代基位置-取代基名称母体名称
③阿拉伯数字表示取代基位置,汉字数字表示相同取代基的个数
6、比较同类烃的沸点:
(1)一看:碳原子数多沸点高。
(2)碳原子数相同,二看:支链多沸点低。常温下,碳原子数1-4的烃都为气体。
二、烃的衍生物
1、乙醇和乙酸的性质比较
有机物
饱和一元醇
饱和一元醛
饱和一元羧酸
通式
CnH2n 1OH
——
CnH2n 1COOH
代表物
乙醇
乙醛
乙酸
结构简式
CH3CH2OH
或 C2H5OH
CH3CHO
CH3COOH
官能团
羟基:-OH
醛基:-CHO
羧基:-COOH
物理性质
无色、有特殊香味的液体,俗名酒精,与水互溶,易挥发
(非电解质)
——
有强烈刺激性气味的无色液体,俗称醋酸,易溶于水和乙醇,无水醋酸又称冰醋酸。
用途
作燃料、饮料、化工原料;用于医疗消毒,乙醇溶液的质量分数为75%
——
有机化工原料,可制得醋酸纤维、合成纤维、香料、燃料等,是食醋的主要成分
有机物
主 要 化 学 性 质
乙醇
①与Na的反应
2CH3CH2OH 2Na―→2CH3CH2ONa H2↑
乙醇与Na的反应(与水比较):
①相同点:都生成氢气,反应都放热
②不同点:比钠与水的反应要缓慢
结论:乙醇分子羟基中的氢原子比烷烃分子中的氢原子活泼,但没有水分子中的氢原子活泼。
②氧化反应
(ⅰ)燃烧
CH3CH2OH 3O2―→2CO2 3H2O
(ⅱ)在铜或银催化条件下:可以被O2氧化成乙醛(CH3CHO)
2CH3CH2OH O2――→2CH3CHO 2H2O
③消去反应
CH3CH2OH――→CH2=CH2↑ H2O
乙醛
氧化反应:醛基(-CHO)的性质-与银氨溶液,新制Cu(OH)2反应
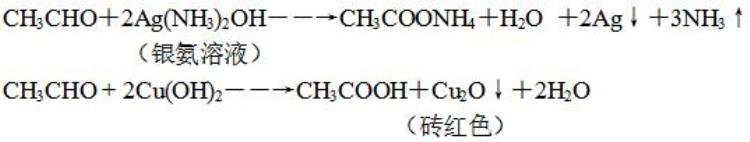
醛基的检验:
方法1:加银氨溶液水浴加热有银镜生成。
方法2:加新制的Cu(OH)2碱性悬浊液加热至沸有砖红色沉淀
乙酸
①具有酸的通性:CH3COOH≒CH3COO-+H+
使紫色石蕊试液变红;
与活泼金属,碱,弱酸盐反应,如CaCO3、Na2CO3
酸性比较:CH3COOH > H2CO3
2CH3COOH+CaCO3=2(CH3COO)2Ca+CO2↑+H2O(强制弱)
②酯化反应
CH3COOH+C2H5OH CH3COOC2H5+H2O
酸脱羟基醇脱氢
三、基本营养物质
种类
元素
代表物
代表物分子
糖类
单糖
C H O
葡萄糖
C6H12O6
葡萄糖和果糖互为同分异构体
单糖不能发生水解反应
果糖
双糖
C H O
蔗糖
C12H22O11
蔗糖和麦芽糖互为同分异构体
能发生水解反应
麦芽糖
多糖
C H O
淀粉
(C6H10O5)n
淀粉、纤维素由于n值不同,所以分子式不同,不能互称同分异构体
能发生水解反应
纤维素
油脂
油
C H O
植物油
不饱和高级脂肪酸甘油酯
含有C=C键,能发生加成反应,
能发生水解反应
脂
C H O
动物脂肪
饱和高级脂肪酸甘油酯
C-C键,
能发生水解反应
蛋白质
C H O
N S P等
酶、肌肉、
毛发等
氨基酸连接成的高分子
能发生水解反应
主 要 化 学 性 质
葡萄糖
结构简式:CH2OH-CHOH-CHOH-CHOH-CHOH-CHO
或CH2OH(CHOH)4CHO(含有羟基和醛基)
醛基:
①使新制的Cu(OH)2产生砖红色沉淀-测定糖尿病患者病情
②与银氨溶液反应产生银镜-工业制镜和玻璃瓶瓶胆
羟基:与羧酸发生酯化反应生成酯
蔗糖
水解反应:生成葡萄糖和果糖
淀粉
纤维素
淀粉、纤维素水解反应:生成葡萄糖
淀粉特性:淀粉遇碘单质变蓝
油脂
水解反应:生成高级脂肪酸(或高级脂肪酸盐)和甘油
蛋白质
水解反应:最终产物为氨基酸
颜色反应:蛋白质遇浓HNO3变黄(鉴别部分蛋白质)
灼烧蛋白质有烧焦羽毛的味道(鉴别蛋白质)
食物中的营养物质包括:糖类、油脂、蛋白质、维生素、无机盐和水。人们习惯称糖类、油脂、蛋白质为动物性和植物性食物中的基本营养物质。
第四章 化学与自然资源的开发利用

第一节 开发利用金属矿物和海水资源
一、金属矿物的开发利用
1、金属的存在:除了金、铂等少数金属外,绝大多数金属以化合态的形式存在于自然界。
2、金属冶炼的涵义:简单地说,金属的冶炼就是把金属从矿石中提炼出来。金属冶炼的实质是把金属元素从化合态还原为游离态,即

3、金属冶炼的一般步骤:
(1)矿石的富集:除去杂质,提高矿石中有用成分的含量。
(2)冶炼:利用氧化还原反应原理,在一定条件下,用还原剂把金属从其矿石中还原出来,得到金属单质(粗)。
(3)精炼:采用一定的方法,提炼纯金属。
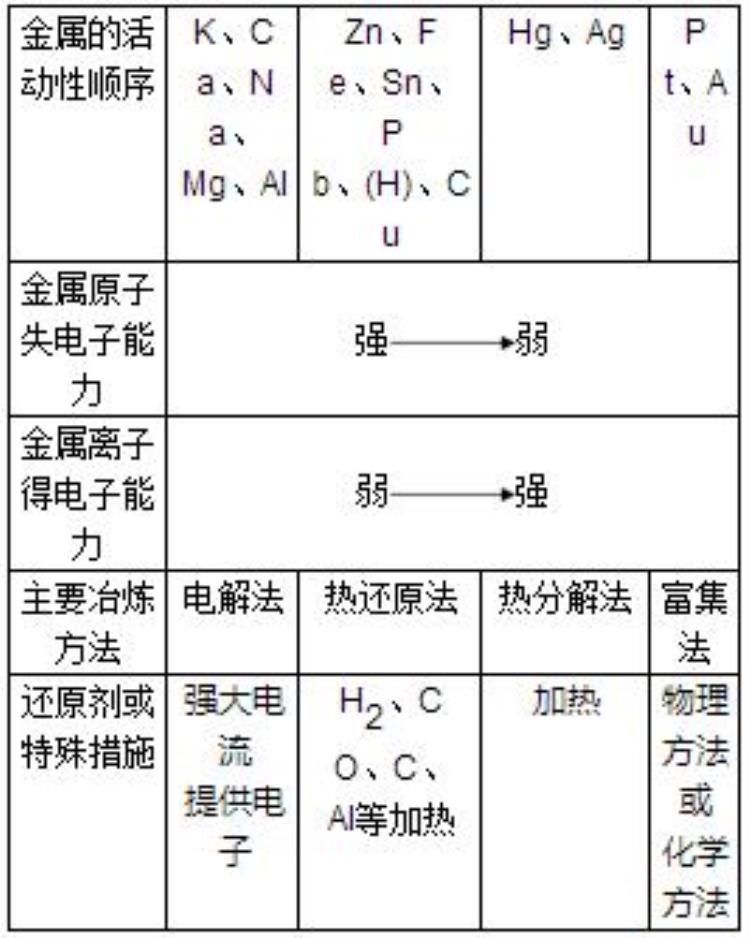
4、金属冶炼的方法
(1)电解法:适用于一些非常活泼的金属。

(2)热还原法:适用于较活泼金属。

常用的还原剂:焦炭、CO、H2等。一些活泼的金属也可作还原剂,如Al,

(3)热分解法:适用于一些不活泼的金属。

5、(1)回收金属的意义:节约矿物资源,节约能源,减少环境污染。
(2)废旧金属的最好处理方法是回收利用。
(3)回收金属的实例:废旧钢铁用于炼钢;废铁屑用于制铁盐;从电影业、照相业、科研单位和医院X光室回收的定影液中,可以提取金属银。
二、海水资源的开发利用
1、海水是一个远未开发的巨大化学资源宝库。海水中含有80多种元素,其中Cl、Na、K、Mg、Ca、S、C、F、B、Br、Sr 11种元素的含量较高,其余为微量元素。常从海水中提取食盐,并在传统海水制盐工业基础上制取镁、钾、溴及其化合物。
2、海水淡化的方法:蒸馏法、电渗析法、离子交换法等。其中蒸馏法的历史最久,蒸馏法的原理是把水加热到水的沸点,液态水变为水蒸气与海水中的盐分离,水蒸气冷凝得淡水。
3、海水提溴
有关反应方程式:
①2NaBr+Cl2=Br2+2NaCl
②Br2+SO2+2H2O=2HBr+H2SO4
③2HBr+Cl2=2HCl+Br2
4、海带提碘
海带中的碘元素主要以I-的形式存在,提取时用适当的氧化剂将其氧化成I2,再萃取出来。证明海带中含有碘,实验方法:
(1)用剪刀剪碎海带,用酒精湿润,放入坩锅中。
(2)灼烧海带至完全生成灰,停止加热,冷却。
(3)将海带灰移到小烧杯中,加蒸馏水,搅拌、煮沸、过滤。
(4)在滤液中滴加稀H2SO4及H2O2然后加入几滴淀粉溶液。
证明含碘的现象:滴入淀粉溶液,溶液变蓝色。2I-+H2O2+2H+=I2+2H2O
第二节 资源综合利用、环境保护
一、煤和石油
1、煤的组成:煤是由有机物和少量无机物组成的复杂混合物,主要含碳元素,还含有少量的氢、氧、氮、硫等元素。
2、煤的综合利用:煤的干馏、煤的气化、煤的液化。
煤的干馏是指将煤在隔绝空气的条件下加强使其分解的过程,也叫煤的焦化。
煤干馏得到焦炭、煤焦油、焦炉气等。
煤的气化是将其中的有机物转化为可燃性气体的过程。
煤的液化是将煤转化成液体燃料的过程。
3、石油的组成:石油主要是多种烷烃、环烷烃和芳香烃多种碳氢化合物的混合物,没有固定的沸点。
4、石油的加工:石油的分馏、催化裂化、裂解。
二、环境保护和绿色化学
环境问题主要是指由于人类不合理地开发和利用自然资源而造成的生态环境破坏,以及工农业生产和人类生活所造成的环境污染。
1、环境污染
(1)大气污染
大气污染物:颗粒物(粉尘)、硫的氧化物(SO2和SO3)、氮的氧化物(NO和NO2)、CO、碳氢化合物,以及氟氯代烷等。
大气污染的防治:合理规划工业发展和城市建设布局;调整能源结构;运用各种防治污染的技术;加强大气质量监测;充分利用环境自净能力等。
(2)水污染
水污染物:重金属(Ba2+、Pb2+等)、酸、碱、盐等无机物,耗氧物质,石油和难降解的有机物,洗涤剂等。
水污染的防治方法:控制、减少污水的任意排放。
(3)土壤污染
土壤污染物:城市污水、工业废水、生活垃圾、工矿企业固体废弃物、化肥、农药、大气沉降物、牲畜排泄物、生物残体。
土壤污染的防治措施:控制、减少污染源的排放。
2、绿色化学
绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染。按照绿色化学的原则,最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物(即没有副反应,不生成副产物,更不能产生废弃物),这时原子利用率为100%。
3、环境污染的热点问题:
(1)形成酸雨的主要气体为SO2和NOx。
(2)破坏臭氧层的主要物质是氟利昂(CCl2F2)和NOx。
(3)导致全球变暖、产生“温室效应”的气体是CO2。
(4)光化学烟雾的主要原因是汽车排出的尾气中氮氧化物、一氧化氮、碳氢化合物。
(5)“白色污染”是指聚乙烯等塑料垃圾。
(6)引起赤潮的原因:工农业及城市生活污水含大量的氮、磷等营养元素。(含磷洗衣粉的使用和不合理使用磷肥是造成水体富营养化的重要原因之一。)

楂樹腑鍖栧﹀繀淇浜岀煡璇嗙偣褰掔撼鎬荤粨
銆銆涓閮ㄥ垎鍚屽﹀瑰寲瀛︿笉鏄寰堢啛缁冿紝涓嶇煡閬撹ュ備綍瀛︿範鎬荤粨鐭ヨ瘑鐐癸紝浣嗘槸鍙堟兂瀛﹀ソ鍖栧︺備互涓嬫槸鐢辨垜涓哄ぇ瀹舵暣鐞嗙殑鈥滈珮涓鍖栧﹀繀淇浜岀煡璇嗙偣褰掔撼鎬荤粨鈥濓紝浠呬緵鍙傝冿紝娆㈣繋澶у堕槄璇汇
銆銆 楂樹腑鍖栧﹀繀淇浜岀煡璇嗙偣褰掔撼鎬荤粨銆銆绗涓绔 鐗╄川缁撴瀯 鍏冪礌鍛ㄦ湡寰
銆銆鍘熷瓙搴忔暟=鏍哥數鑽锋暟=璐ㄥ瓙鏁=鍘熷瓙鐨勬牳澶栫數瀛愭暟銆
銆銆鐔熻儗鍓20鍙峰厓绱狅紝鐔熸倝1锝20鍙峰厓绱犲師瀛愭牳澶栫數瀛愮殑鎺掑竷锛
銆銆H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca
銆銆2.鍘熷瓙鏍稿栫數瀛愮殑鎺掑竷瑙勫緥锛
銆銆鈶犵數瀛愭绘槸灏藉厛鎺掑竷鍦ㄨ兘閲忔渶浣庣殑鐢靛瓙灞傞噷;
銆銆鈶″悇鐢靛瓙灞傛渶澶氬圭撼鐨勭數瀛愭暟鏄2n2;
銆銆鈶㈡渶澶栧眰鐢靛瓙鏁颁笉瓒呰繃8涓(K灞備负鏈澶栧眰涓嶈秴杩2涓)锛屾″栧眰涓嶈秴杩18涓锛屽掓暟绗涓夊眰鐢靛瓙鏁颁笉瓒呰繃32涓銆
銆銆3.鍏冪礌銆佹牳绱犮佸悓浣嶇礌銆
銆銆鍏冪礌锛氬叿鏈夌浉鍚屾牳鐢佃嵎鏁扮殑鍚屼竴绫诲師瀛愮殑鎬荤О銆
銆銆鏍哥礌锛氬叿鏈変竴瀹氭暟鐩鐨勮川瀛愬拰涓瀹氭暟鐩鐨勪腑瀛愮殑涓绉嶅師瀛愩
銆銆鍚屼綅绱狅細璐ㄥ瓙鏁扮浉鍚岃屼腑瀛愭暟涓嶅悓鐨勫悓涓鍏冪礌鐨勪笉鍚屽師瀛愪簰绉颁负鍚屼綅绱犮(瀵逛簬鍘熷瓙鏉ヨ)
銆銆 浜屻佸厓绱犲懆鏈熻〃
銆銆1.缂栨帓鍘熷垯锛
銆銆鈶犳寜鍘熷瓙搴忔暟閫掑炵殑椤哄簭浠庡乏鍒板彸鎺掑垪銆
銆銆鈶″皢鐢靛瓙灞傛暟鐩稿悓鐨勫悇鍏冪礌浠庡乏鍒板彸鎺掓垚涓妯琛屻(鍛ㄦ湡搴忔暟=鍘熷瓙鐨勭數瀛愬眰鏁)
銆銆鈶㈡妸鏈澶栧眰鐢靛瓙鏁扮浉鍚岀殑鍏冪礌鎸夌數瀛愬眰鏁伴掑炵殑椤哄簭浠庝笂鍒颁笅鎺掓垚涓绾佃屻
銆銆涓绘棌搴忔暟=鍘熷瓙鏈澶栧眰鐢靛瓙鏁般
銆 銆涓夈佸厓绱犲懆鏈熷緥
銆銆1.鍏冪礌鍛ㄦ湡寰嬶細鍏冪礌鐨勬ц川(鏍稿栫數瀛愭帓甯冦佸師瀛愬崐寰勩佷富瑕佸寲鍚堜环銆侀噾灞炴с侀潪閲戝睘鎬)闅忕潃鏍哥數鑽锋暟鐨勯掑炶屽憟鍛ㄦ湡鎬у彉鍖栫殑瑙勫緥銆傝繀鍗滅尽鍏冪礌鎬ц川鐨勫懆鏈熸у彉鍖栧疄璐ㄦ槸鍏冪礌鍘熷瓙鏍稿栫數瀛愭帓甯冪殑鍛ㄦ湡鎬у彉鍖栫殑蹇呯劧缁撴灉銆
銆銆 鍥涖佸寲瀛﹂敭
銆銆鍖栧﹂敭鏄鐩搁偦涓や釜鎴栧氫釜鍘熷瓙闂村己鐑堢殑鐩镐簰浜╂媿浣滅敤銆
銆銆鎷撳睍闃呰伙細鑰冭瘯鎬庝箞澶嶄範鍖栧銆銆1銆佺爺绌惰冭瘯澶х翰锛屽垎鍧楄惤瀹
銆銆鑰冭瘯璇存槑鍜岃冭瘯澶х翰鏄澶囪冪殑鎸囧崡閽堬紝澶嶄範鍖栧︽椂搴旇ヨょ湡鐮旂┒鑰冭瘯璇存槑鍜岃冭瘯澶х翰銆傚钩甯告垜浠鍙浠ュ炲己鍖栧﹀︾戝嶄範鐨勯拡瀵规у拰鏂瑰悜鎬э紝閬垮厤鍑虹幇鐩茬洰澶囪冪殑鎯呭喌銆
銆銆瑕佺悊瑙i珮鑰冪殑鍛介樹緷鎹锛屽瑰寲瀛︾殑鑰冪翰瀹為檯鎿嶄綔鏄锛氳冪翰涓嶈佹眰鐨勪笉澶嶄範锛岃冪翰闄嶄綆瑕佹眰鐨勪笉鎷撳睍锛岃冪翰鎵瑕佹眰鐨勫ぇ鍔涘嶄範銆
銆銆鍦ㄤ笂瀛︽湡鐨勪竴杞澶嶄範鏃讹紝鎴戜滑鏍规嵁璁″垝鍒嗕负鍥涗釜闃舵碉細绗涓娆¤仈鑰冨皢鐗╄川鐨勯噺銆佹哀鍖栬繕鍘熷弽搴斻佺诲瓙鍙嶅簲鍙婂厓绱犲寲鍚堢墿澶嶄範瀹屻傜浜屾¤仈鑰冨皢鐗╄川鍒嗙被銆佸厓绱犲懆鏈熷緥銆佺數鍖栧﹀嶄範瀹屻傜涓夋¤仈鑰冩椂灏嗗寲瀛﹀弽搴旈熺巼銆佸寲瀛﹀钩琛°佺數瑙h川婧舵恫澶嶄範瀹屻傜瓑鍒板競缁熸祴鏃跺啀鎶婃湁鏈哄寲瀛﹀嶄範瀹岋紝浜夊彇骞村亣鍓嶅畬鎴愪竴杞澶嶄範銆
銆 銆2銆佹槑纭鏂瑰悜銆佸圭棁涓嬭嵂
銆銆缁忚繃瀵硅繎鍑犲勾鍖栧﹂珮鑰冮樼殑鍒嗘瀽锛屽彲浠ュ緱鍑轰笁鐐癸細涓鏄涓诲共鐭ヨ瘑鑰冩煡鐨勨滈泦涓鍖栤濓紝浜屾槸鍩虹鐭ヨ瘑鐨勬柊瑙嗚掞紝涓夋槸鑳藉姏鑰冩煡鐨勨滅患鍚堝寲鈥濄
銆銆瑕佹彁楂樺寲瀛︾殑澶囪冭川閲忥紝杩樿佺湡姝d簡瑙h嚜韬瀛樺湪鐨勯棶棰橈紝鍙鏈夎繖鏍峰囪冩墠鑳芥洿鍔犵戝︽湁鏁堛傛墍浠ヨ佹槑纭澶囪冩柟鍚戯紝瀵圭棁寮鏂逛笅鑽锛屾墠鑳戒娇鑷韬鐨勭煡璇嗙粨鏋勬洿鍔犵﹀悎楂樿冪殑鍖栧︾珛浣撶綉缁滃寲瑕佹眰锛屾墠鑳藉疄鐜板熀纭鈫掕兘鍔涒啋鍒嗘暟鐨勮浆鍖栥
銆銆楂樹腑鍖栧︽暀瀛︾殑閲嶇偣鍐呭规槸鍖栧︽傚康鍜岀悊璁恒佸厓绱犲寲鍚堢墿鍙婄浉鍏冲疄楠屽拰璁$畻銆傚规ゅ湪澶嶄範涓闄や簡璁╁︾敓鎺屾彙姒傚康鐞嗚虹殑鍏蜂綋鍐呭逛箣澶栬繕鏁寸悊浜嗗ぇ閲忔槗閿欐槗娣风殑鍒ゆ柇棰樿╁︾敓寮婅剨缁冧範锛屽湪鍏冪礌鍖栧悎鐗╁嶄範涓瀵逛簬鍖栧﹀弽搴旀柟绋嬪紡銆佺诲瓙鏂圭▼寮忋佺數鍖栧︽柟绋嬪紡瀛︾敓浠閮芥帉鎻′笉浜嗭紝鎴戜滑閫氳繃姣忓ぉ灏忕粌銆佽惧爞棰樺啓绛夋帾鏂戒娇瀛︾敓閮藉熀鏈鎺屾彙浣忎簡銆傚湪鍖栧﹀疄楠屽嶄範褰撲腑鎶婂父瑙佷华鍣ㄧ殑浣跨敤銆佹敞鎰忎簨椤广佸疄楠岀殑鍩烘湰鎿嶄綔銆侀櫎鏉傝呯疆銆侀櫎灏捐呯疆绛夊垎闂ㄥ埆绫绘荤粨鎴愯〃鏍肩殑褰㈠紡鍗板彂缁欏︾敓锛屽彇寰椾簡寰堝ソ鐨勬晥鏋溿傚寲瀛﹁$畻鏄鎵鏁欏︾敓鏈钖勫急涔嬮」锛屽湪澶嶄範涓閽堝归珮鑰冨父瑙佺殑棰樺瀷灏嗗畧鎭掓硶銆佸樊閲忔硶銆佹瀬鍊兼硶銆佽ㄨ烘硶绛夊氭$粰瀛︾敓璁茶В缁冧範锛屼娇瀛︾敓鐨勭煭鏉垮緱浠ュ讥琛ャ
銆銆楂樹腑鍖栧︽暀瀛﹂毦鐐规湁鍥涘勶細鍖栧﹀钩琛$Щ鍔ㄧ殑鍒ゆ柇銆佹憾娑蹭腑绂诲瓙娴撳害鐨勬瘮杈冦佹湁鏈哄寲鍚堢墿鍚屽垎寮傛瀯浣撶殑鎺ㄦ柇鍜屽寲瀛﹁$畻銆傚逛簬杩欎簺闅剧偣鏁欏︽垜浠鍒╃敤鍕掑忕壒鍒楀師鐞嗐佷笁澶у畧鎭掕勫緥銆佸垎纰虫硶銆佹彃鍏ユ硶銆佸畧鎭掓硶銆佸樊閲忔硶鏋佸兼硶绛夋湁鏁堟柟娉曠粰瀛︾敓鍒嗘瀽娓呮氾紝鍋氬埌浜嗛毦鐐圭殑绐佺牬銆
銆銆楂樿冩椂鍖栧︽瘡骞撮兘瑕佽冨埌瀹㈣傞樻棤澶栦箮鏈夛細鍖栧︿笌鐢熸椿銆佺幆澧冦佽兘婧愰;蹇呬慨浜屾湁鏈洪;绠鍗曞疄楠岄;闃夸紡浼藉痉缃楀父鏁伴;鍏冪礌鍛ㄦ湡寰嬫帹鏂棰;鐢靛寲瀛﹂;鐢佃В璐ㄦ憾娑茬數绂荤诲瓙娴撳害棰;婧跺害绉鍥惧儚棰樼瓑锛屼富瑙傞樺瀷涓昏佹槸涓閬撶敱瀹為獙涓轰富绾跨殑濉绌洪橈紝涓閬撶敱宸ヨ壓娴佺▼涓轰富绾跨殑缁煎悎棰橈紝涓閬撶敱閫変慨鍥涘寲瀛﹀師鐞嗕负涓荤嚎鐨勭患鍚堥橈紝涓閬撻変慨涓夋垨閫変慨浜旂殑閫夊仛棰樸傛墍浠ユ垜浠鎶婂钩鏃剁殑缁冧範璁捐℃垚鑰冭瘯鍖栵紝骞虫椂鐨勮冭瘯楂樿冨寲锛屽归珮鑰冧腑楂橀戣冪偣鑷濮嬭嚦缁堟垜鍦ㄧ粌涔犻樸佽冭瘯棰樹腑銆
銆銆 3銆佸洖褰掑熀纭銆佹彁楂樿兘鍔
銆銆楂樿冪殑鍖栧﹀嶄範璁缁冭佸仛鍒板己鍖栧熀纭锛岃繖闇瑕佹垜浠涓嶆柇鍦拌繘琛屾荤粨銆傚彧鏈夐氳繃涓嶆柇鍦版荤粨锛屾垜浠鐨勫嵃璞℃墠浼氭洿鍔犳繁鍒伙紝搴旂敤鐭ヨ瘑鐐逛細鏇村姞鐏垫椿銆
銆銆鍦ㄥ垰杩涘叆鍖栧︿竴杞澶嶄範鏃讹紝鎴戜滑灏辩粰瀛︾敓鍗板埗浜嗐婇珮鑰冨墠鍥炲綊璇炬湰鐭ヨ瘑鐐广嬶紝璁╁︾敓瀵圭潃闂棰橀槄璇昏炬湰銆傚湪姣忎竴鍗曞厓澶嶄範鏃讹紝鎴戜滑鎬绘槸鎼滈泦涓庝箣鐩稿叧鐨勮繎涓ゅ勾楂樿冪湡棰樺拰鍚勫湴鏂伴栫殑妯℃嫙璇曢樼粰瀛︾敓浠缁冧範銆傚湪鍖栧﹀囪冩椂锛岃佹敞鎰忎粠浜斾釜鏂归潰鐨勭獊鐮村彛瀵绘壘鏂瑰悜:涓鏄杩欓亾棰樺簲璇ユ庝箞鍋;浜屾槸涓轰粈涔堣佽繖鏍峰仛;涓夋槸鎬庝箞浼氭兂鍒拌佽繖鏍峰仛;鍥涙槸涓嶈繖鏍峰仛鍙浠ュ悧?浜旀槸杩欓亾棰樻敼鍙樿鹃棶瑙掑害锛岃繕浼氬彉鎴愪粈涔堟牱鐨勯樼洰?鍙堣ユ庝箞鍋?瀹屾垚涓婅堪鐨勬墍鏈夋ラわ紝瀛︿範鍖栧︾殑鏁堢巼浼氬ぇ澶у炲姞銆

楂樹腑鍖栧﹀繀淇浜岀煡璇嗙偣褰掔撼鏁寸悊
銆銆寰堝氬悓瀛﹀湪澶嶄範楂樹腑鍖栧﹀繀淇浜屾椂锛屽洜涓轰箣鍓嶆病鏈夊仛杩囩郴缁熺殑鎬荤粨锛屽艰嚧澶嶄範鏃舵晥鐜囦笉楂樸備笅闈㈡槸鐢辨垜涓哄ぇ瀹舵暣鐞嗙殑鈥滈珮涓鍖栧﹀繀淇浜岀煡璇嗙偣褰掔撼鏁寸悊鈥濓紝浠呬緵鍙傝冿紝娆㈣繋澶у堕槄璇绘湰鏂囥
銆銆鍖栧﹀繀淇浜屽繀鑰冪煡璇嗙偣1
銆銆鍏冪礌鍛ㄦ湡琛ㄤ竴銆佸師瀛愬簭鏁=鏍哥數鑽锋暟=璐ㄥ瓙鏁=鏍稿栫數瀛愭暟
銆銆1銆佸厓绱犲懆鏈熻〃鐨勭紪鎺掑師鍒欙細
銆銆鈶犳寜鐓у師瀛愬簭鏁伴掑炵殑椤哄簭浠庡乏鍒板彸鎺掑垪;
銆銆鈶″皢鐢靛瓙灞傛暟鐩稿悓鐨勫厓绱犳帓鎴愪竴涓妯琛屸斺斿懆鏈;
銆銆鈶㈡妸鏈澶栧眰鐢靛瓙鏁扮浉鍚岀殑鍏冪礌鎸夌數瀛愬眰鏁伴掑炵殑椤哄簭浠庝笂鍒颁笅鎺掓垚绾佃屸斺旀棌
銆銆2銆佸備綍绮剧‘琛ㄧず鍏冪礌鍦ㄥ懆鏈熻〃涓鐨勪綅缃锛
銆銆鍛ㄦ湡搴忔暟=鐢靛瓙灞傛暟;涓绘棌搴忔暟=鏈澶栧眰鐢靛瓙鏁
銆銆鍙h瘈锛氫笁鐭涓夐暱涓涓嶅叏;涓冧富涓冨壇闆跺叓鏃
銆銆鐔熻帮細涓変釜鐭鍛ㄦ湡锛岀涓鍜岀涓冧富鏃忓拰闆舵棌鐨勫厓绱犵﹀彿鍜屽悕绉
銆銆3銆佸厓绱犻噾灞炴у拰闈為噾灞炴у垽鏂渚濇嵁锛
銆銆鈶犲厓绱犻噾灞炴у己寮辩殑鍒ゆ柇渚濇嵁锛
銆銆鍗曡川璺熸按鎴栭吀璧峰弽搴旂疆鎹㈠嚭姘㈢殑闅炬槗;
銆銆鍏冪礌鏈楂樹环姘чⅳ搴嗗寲鐗╃殑姘村寲鐗┾斺旀阿姘у寲鐗╃殑纰辨у己寮;缃鎹㈠弽搴斻
銆銆鈶″厓绱犻潪閲戝睘鎬у己寮辩殑鍒ゆ柇渚濇嵁锛
銆銆鍗曡川涓庢阿姘旂敓鎴愭皵鎬佹阿鍖栫墿鐨勯毦鏄撳強姘旀佹阿鍖栫墿鐨勭ǔ瀹氭;
銆銆鏈楂樹环姘у寲鐗╁瑰簲鐨勬按鍖栫墿鐨勯吀鎬у己寮;缃鎹㈠弽搴斻
銆銆4銆佹牳绱狅細鍏锋湁涓瀹氭暟鐩鐨勮川瀛愬拰涓瀹氭暟鐩鐨勪腑瀛愮殑涓绉嶅師瀛愩
銆銆鈶犺川閲忔暟==璐ㄥ瓙鏁+涓瀛愭暟锛欰==Z+N
銆銆鈶″悓浣嶇礌锛氳川瀛愭暟鐩稿悓鑰屼腑瀛愭暟涓嶅悓鐨勫悓涓鍏冪礌鐨勪笉鍚屽師瀛愶紝浜掔О鍚屼綅绱犮(鍚屼竴鍏冪礌鐨勫悇绉嶅悓浣嶇礌鐗╃悊鎬ц川涓嶅悓锛屽寲瀛︽ц川鐩稿悓)
銆銆浜屻佸厓绱犲懆鏈熷緥
銆銆1銆佸奖鍝嶅師瀛愬崐寰勫ぇ灏忕殑鍥犵礌锛氣憼鐢靛瓙灞傛暟锛氱數瀛愬眰鏁拌秺澶氾紝鍘熷瓙鍗婂緞瓒婂ぇ(鏈涓昏佸洜绱)
銆銆鈶℃牳鐢佃嵎鏁帮細鏍哥數鑽锋暟澧炲氾紝鍚稿紩鍔涘炲ぇ锛屼娇鍘熷瓙鍗婂緞鏈夊噺灏忕殑瓒嬪悜(娆¤佸洜绱)
銆銆鈶㈡牳澶栫數瀛愭暟锛氱數瀛愭暟澧炲氾紝澧炲姞浜嗙浉浜掓帓鏂ワ紝浣垮師瀛愬崐寰勬湁澧炲ぇ鐨勫惧悜
銆銆2銆佸厓绱犵殑鍖栧悎浠蜂笌鏈澶栧眰鐢靛瓙鏁扮殑鍏崇郴锛氭渶楂樻d环绛変簬鏈澶栧眰鐢靛瓙鏁(姘熸哀鍏冪礌鏃犳d环)
銆銆璐熷寲鍚堜环鏁=8鈥旀渶澶栧眰鐢靛瓙鏁(閲戝睘鍏冪礌鏃犺礋鍖栧悎浠)
銆銆3銆佸悓涓绘棌銆佸悓鍛ㄦ湡鍏冪礌鐨勭粨鏋勩佹ц川閫掑彉瑙勫緥锛
銆銆鍚屼富鏃忥細浠庝笂鍒颁笅锛岄殢鐢靛瓙灞傛暟鐨勯掑烇紝鍘熷瓙鍗婂緞澧炲ぇ锛屾牳瀵瑰栧眰鐢靛瓙鍚稿紩鑳藉姏鍑忓急锛屽け鐢靛瓙鑳藉姏澧炲己锛岃繕鍘熸(閲戝睘鎬)閫愭笎澧炲己锛屽叾绂诲瓙鐨勬哀鍖栨у噺寮便
銆銆鍚屽懆鏈燂細宸︹啋鍙筹紝鏍哥數鑽锋暟鈥斺斺啋閫愭笎澧炲氾紝鏈澶栧眰鐢靛瓙鏁扳斺斺啋閫愭笎澧炲
銆銆鍘熷瓙鍗婂緞鈥斺斺啋閫愭笎鍑忓皬锛屽緱鐢靛瓙鑳藉姏鈥斺斺啋閫愭笎澧炲己锛屽け鐢靛瓙鑳藉姏鈥斺斺啋閫愭笎鍑忓急
銆銆姘у寲鎬р斺斺啋閫愭笎澧炲己锛岃繕鍘熸р斺斺啋閫愭笎鍑忓急锛屾皵鎬佹阿鍖栫墿绋冲畾鎬р斺斺啋閫愭笎澧炲己
銆銆鏈楂樹环姘у寲鐗╁瑰簲姘村寲鐗╅吀鎬р斺斺啋閫愭笎澧炲己锛岀⒈鎬р斺斺啋閫愭笎鍑忓急
銆銆鍖栧﹂敭
銆銆鍚鏈夌诲瓙閿鐨勫寲鍚堢墿灏辨槸绂诲瓙鍖栧悎鐗;鍙鍚鏈夊叡浠烽敭鐨勫寲鍚堢墿鎵嶆槸鍏变环鍖栧悎鐗┿
銆銆NaOH涓鍚鏋佹у叡浠烽敭涓庣诲瓙鑼勮獕鎻¢敭锛孨H4Cl涓鍚鏋佹у叡浠烽敭涓庣诲瓙閿锛孨a2O2涓鍚闈炴瀬鎬у叡浠烽敭涓庣诲瓙閿锛孒2O2涓鍚鏋佹у拰闈炴瀬鎬у叡浠烽敭
銆銆鍖栧﹀繀淇浜屽繀鑰冪煡璇嗙偣2
銆銆鍖栧﹁兘涓銆佸寲瀛﹁兘涓庣儹鑳
銆銆1銆佸湪浠讳綍鐨勫寲瀛﹀弽搴斾腑鎬讳即鏈夎兘閲忕殑鍙樺寲銆
銆銆鍘熷洜锛氬綋鐗╄川鍙戠敓鍖栧﹀弽搴旀椂锛屾柇寮鍙嶅簲鐗╀腑鐨勫寲瀛﹂敭瑕佸惛鏀惰兘閲忥紝鑰屽舰鎴愮敓鎴愮墿涓鐨勫寲瀛﹂敭瑕佹斁鍑鸿兘閲忋傚寲瀛﹂敭鐨勬柇瑁傚拰褰㈡垚鏄鍖栧﹀弽搴斾腑鑳介噺鍙樺寲鐨勪富瑕佸師鍥犮備竴涓纭瀹氱殑鍖栧﹀弽搴斿湪鍙戠敓杩囩▼涓鏄鍚告敹鑳介噺杩樻槸鏀惧嚭鑳介噺锛屽喅瀹氫簬鍙嶅簲鐗╃殑鎬昏兘閲忎笌鐢熸垚鐗╃殑鎬昏兘閲忕殑鐩稿瑰ぇ灏忋侲鍙嶅簲鐗╂昏兘閲>E鐢熸垚鐗╂昏兘閲忥紝涓烘斁鐑鍙嶅簲銆侲鍙嶅簲鐗╂昏兘閲
銆銆2銆佸父瑙佺殑鏀剧儹鍙嶅簲鍜屽惛鐑鍙嶅簲
銆銆甯歌佺殑鏀剧儹鍙嶅簲锛氣憼鎵鏈夌殑鐕冪儳涓庣紦鎱㈡哀鍖栥傗憽閰哥⒈涓鍜屽弽搴斻傗憿閲戝睘涓庨吀銆佹按鍙嶅簲鍒舵阿姘斻
銆銆鈶eぇ澶氭暟鍖栧悎鍙嶅簲(鐗规畩锛欳+CO22CO鏄鍚哥儹鍙嶅簲)銆
銆銆甯歌佺殑鍚哥儹鍙嶅簲锛氣憼浠C銆丠2銆丆O涓鸿繕鍘熷墏鐨勬哀鍖栬繕鍘熷弽搴斿傦細C(s)+H2O(g)=CO(g)+H2(g)銆
銆銆鈶¢摰鐩愬拰纰辩殑鍙嶅簲濡侭a(OH)2?8H2O+NH4Cl=BaCl2+2NH3鈫+10H2O
銆銆鈶㈠ぇ澶氭暟鍒嗚В鍙嶅簲濡侹ClO3銆並MnO4銆丆aCO3鐨勫垎瑙g瓑銆
銆銆浜屻佸寲瀛﹁兘涓庣數鑳
銆銆1銆佸寲瀛﹁兘杞鍖栦负鐢佃兘鐨勬柟寮忥細
銆銆鐢佃兘
銆銆(鐢靛姏)鐏鐢(鐏鍔涘彂鐢)鍖栧﹁兘鈫掔儹鑳解啋鏈烘拌兘鈫掔數鑳界己鐐癸細鐜澧冩薄鏌撱佷綆鏁
銆銆鍘熺數姹犲皢鍖栧﹁兘鐩存帴杞鍖栦负铏氭瘯鐢佃兘浼樼偣锛氭竻娲併侀珮鏁
銆銆2銆佸師鐢垫睜鍘熺悊(1)姒傚康锛氭妸鍖栧﹁兘鐩存帴杞鍖栦负鐢佃兘鐨勮呯疆鍙鍋氬師鐢垫睜銆
銆銆(2)鍘熺數姹犵殑宸ヤ綔鍘熺悊锛氶氳繃姘у寲杩樺師鍙嶅簲(鏈夌數瀛愮殑杞绉)鎶婂寲瀛﹁兘杞鍙樹负鐢佃兘銆
銆銆(3)鏋勬垚鍘熺數姹犵殑鏉′欢锛(1)鏈夋椿娉兼т笉鍚岀殑涓や釜鐢垫瀬;(2)鐢佃В璐ㄦ憾娑(3)闂鍚堝洖璺(4)鑷鍙戠殑姘у寲杩樺師鍙嶅簲
銆銆(4)鐢垫瀬鍚嶇О鍙婂彂鐢熺殑鍙嶅簲锛
銆銆璐熸瀬锛氳緝娲绘臣鐨勯噾灞炰綔璐熸瀬锛岃礋鏋佸彂鐢熸哀鍖栧弽搴旓紝
銆銆鐢垫瀬鍙嶅簲寮忥細杈冩椿娉奸噾灞-ne-=閲戝睘闃崇诲瓙
銆銆璐熸瀬鐜拌薄锛氳礋鏋佹憾瑙o紝璐熸瀬璐ㄩ噺鍑忓皯銆
銆銆姝f瀬锛氳緝涓嶆椿娉肩殑閲戝睘鎴栫煶澧ㄤ綔姝f瀬锛屾f瀬鍙戠敓杩樺師鍙嶅簲锛
銆銆鐢垫瀬鍙嶅簲寮忥細婧舵恫涓闃崇诲瓙+ne-=鍗曡川
銆銆姝f瀬鐨勭幇璞★細涓鑸鏈夋皵浣撴斁鍑烘垨姝f瀬璐ㄩ噺澧炲姞銆
銆銆(5)鍘熺數姹犳h礋鏋佺殑鍒ゆ柇鏂规硶锛
銆銆鈶犱緷鎹鍘熺數姹犱袱鏋佺殑鏉愭枡锛
銆銆杈冩椿娉肩殑閲戝睘浣滆礋鏋(K銆丆a銆丯a澶娲绘臣锛屼笉鑳戒綔鐢垫瀬);
銆銆杈冧笉娲绘臣閲戝睘鎴栧彲瀵肩數闈為噾灞(鐭冲ⅷ)銆佹哀鍖栫墿(MnO2)绛変綔姝f瀬銆
銆銆鈶℃牴鎹鐢垫祦鏂瑰悜鎴栫數瀛愭祦鍚戯細(澶栫數璺)鐨勭數娴佺敱姝f瀬娴佸悜璐熸瀬;鐢靛瓙鍒欑敱璐熸瀬缁忓栫數璺娴佸悜鍘熺數姹犵殑姝f瀬銆
銆銆鈶㈡牴鎹鍐呯數璺绂诲瓙鐨勮縼绉绘柟鍚戯細闃崇诲瓙娴佸悜鍘熺數姹犳f瀬锛岄槾绂诲瓙娴佸悜鍘熺數姹犺礋鏋併
銆銆鈶f牴鎹鍘熺數姹犱腑鐨勫弽搴旂被鍨嬶細
銆銆璐熸瀬锛氬け鐢靛瓙锛屽彂鐢熸哀鍖栧弽搴旓紝鐜拌薄閫氬父鏄鐢垫瀬鏈韬娑堣楋紝璐ㄩ噺鍑忓皬銆
銆銆姝f瀬锛氬緱鐢靛瓙锛屽彂鐢熻繕鍘熷弽搴旓紝鐜拌薄鏄甯镐即闅忛噾灞炵殑鏋愬嚭鎴朒2鐨勬斁鍑恒
銆銆(6)鍘熺數姹犵數鏋佸弽搴旂殑涔﹀啓鏂规硶锛
銆銆(i)鍘熺數姹犲弽搴旀墍渚濇墭鐨勫寲瀛﹀弽搴斿師鐞嗘槸姘у寲杩樺師鍙嶅簲锛岃礋鏋佸弽搴旀槸姘у寲鍙嶅簲锛屾f瀬鍙嶅簲鏄杩樺師鍙嶅簲銆傚洜姝や功鍐欑數鏋佸弽搴旂殑鏂规硶褰掔撼濡備笅锛
銆銆鈶犲啓鍑烘诲弽搴旀柟绋嬪紡銆傗憽鎶婃诲弽搴旀牴鎹鐢靛瓙寰楀け鎯呭喌锛屽垎鎴愭哀鍖栧弽搴斻佽繕鍘熷弽搴斻
銆銆鈶㈡哀鍖栧弽搴斿湪璐熸瀬鍙戠敓锛岃繕鍘熷弽搴斿湪姝f瀬鍙戠敓锛屽弽搴旂墿鍜岀敓鎴愮墿瀵瑰彿鍏ュ骇锛屾敞鎰忛吀纰变粙璐ㄥ拰姘寸瓑鍙備笌鍙嶅簲銆
銆銆(ii)鍘熺數姹犵殑鎬诲弽搴斿紡涓鑸鎶婃f瀬鍜岃礋鏋佸弽搴斿紡鐩稿姞鑰屽緱銆
銆銆(7)鍘熺數姹犵殑搴旂敤锛氣憼鍔犲揩鍖栧﹀弽搴旈熺巼锛屽傜矖閿屽埗姘㈡皵閫熺巼姣旂函閿屽埗姘㈡皵蹇銆傗憽姣旇緝閲戝睘娲诲姩鎬у己寮便傗憿璁捐″師鐢垫睜銆傗懀閲戝睘鐨勯槻鑵愩
銆銆鍖栧﹀繀淇浜屽繀鑰冪煡璇嗙偣3
銆銆鍖栧﹀弽搴旂殑閫熺巼鍜岄檺搴1銆佸寲瀛﹀弽搴旂殑閫熺巼
銆銆(1)姒傚康锛氬寲瀛﹀弽搴旈熺巼閫氬父鐢ㄥ崟浣嶆椂闂村唴鍙嶅簲鐗╂祿搴︾殑鍑忓皯閲忔垨鐢熸垚鐗╂祿搴︾殑澧炲姞閲(鍧囧彇姝e)鏉ヨ〃绀恒
銆銆鈶犲崟浣嶏細mol/(L?s)鎴杕ol/(L?min)
銆銆鈶B涓烘憾娑叉垨姘斾綋锛岃嫢B涓哄浐浣撴垨绾娑蹭綋涓嶈$畻閫熺巼銆
銆銆鈶㈤噸瑕佽勫緥锛氶熺巼姣=鏂圭▼寮忕郴鏁版瘮
銆銆(2)褰卞搷鍖栧﹀弽搴旈熺巼鐨勫洜绱狅細
銆銆鍐呭洜锛氱敱鍙傚姞鍙嶅簲鐨勭墿璐ㄧ殑缁撴瀯鍜屾ц川鍐冲畾鐨(涓昏佸洜绱)銆
銆銆澶栧洜锛氣憼娓╁害锛氬崌楂樻俯搴︼紝澧炲ぇ閫熺巼
銆銆鈶″偓鍖栧墏锛氫竴鑸鍔犲揩鍙嶅簲閫熺巼(姝e偓鍖栧墏)
銆銆鈶㈡祿搴︼細澧炲姞C鍙嶅簲鐗╃殑娴撳害锛屽炲ぇ閫熺巼(婧舵恫鎴栨皵浣撴墠鏈夋祿搴﹀彲瑷)
銆銆鈶e帇寮猴細澧炲ぇ鍘嬪己锛屽炲ぇ閫熺巼(閫傜敤浜庢湁姘斾綋鍙傚姞鐨勫弽搴)
銆銆鈶ゅ叾瀹冨洜绱狅細濡傚厜(灏勭嚎)銆佸浐浣撶殑琛ㄩ潰绉(棰楃矑澶у皬)銆佸弽搴旂墿鐨勭姸鎬(婧跺墏)銆佸師鐢垫睜绛変篃浼氭敼鍙樺寲瀛﹀弽搴旈熺巼銆
銆銆2銆佸寲瀛﹀弽搴旂殑闄愬害鈥斺斿寲瀛﹀钩琛
銆銆(1)鍖栧﹀钩琛$姸鎬佺殑鐗瑰緛锛氶嗐佸姩銆佺瓑銆佸畾銆佸彉銆
銆銆鈶犻嗭細鍖栧﹀钩琛$爺绌剁殑瀵硅薄鏄鍙閫嗗弽搴斻
銆銆鈶″姩锛氬姩鎬佸钩琛★紝杈惧埌骞宠 鐘舵佹椂锛屾i嗗弽搴斾粛鍦ㄤ笉鏂杩涜屻
銆銆鈶㈢瓑锛氳揪鍒板钩琛$姸鎬佹椂锛屾f柟搴旈熺巼鍜岄嗗弽搴旈熺巼鐩哥瓑锛屼絾涓嶇瓑浜0銆傚嵆v姝=v閫嗏墵0銆
銆銆鈶e畾锛氳揪鍒板钩琛$姸鎬佹椂锛屽悇缁勫垎鐨勬祿搴︿繚鎸佷笉鍙橈紝鍚勭粍鎴愭垚鍒嗙殑鍚閲忎繚鎸佷竴瀹氥
銆銆鈶ゅ彉锛氬綋鏉′欢鍙樺寲鏃讹紝鍘熷钩琛¤鐮村潖锛屽湪鏂扮殑鏉′欢涓嬩細閲嶆柊寤虹珛鏂扮殑骞宠 銆
銆銆(3)鍒ゆ柇鍖栧﹀钩琛$姸鎬佺殑鏍囧織锛
銆銆鈶燰A(姝f柟鍚)=VA(閫嗘柟鍚)鎴杗A(娑堣)=nA(鐢熸垚)(涓嶅悓鏂瑰悜鍚屼竴鐗╄川姣旇緝)
銆銆鈶″悇缁勫垎娴撳害淇濇寔涓嶅彉鎴栫櫨鍒嗗惈閲忎笉鍙
銆銆鈶㈠熷姪棰滆壊涓嶅彉鍒ゆ柇(鏈変竴绉嶇墿璐ㄦ槸鏈夐滆壊鐨)
銆銆鈶f荤墿璐ㄧ殑閲忔垨鎬讳綋绉鎴栨诲帇寮烘垨骞冲潎鐩稿瑰垎瀛愯川閲忎笉鍙(鍓嶆彁锛氬弽搴斿墠鍚庢皵浣撶殑鎬荤墿璐ㄧ殑閲忎笉鐩哥瓑鐨勫弽搴旈傜敤锛屽嵆濡傚逛簬鍙嶅簲xA+yBzC锛寈+y鈮爖)
銆銆鎷撳睍闃呰伙細楂樹竴鍖栧﹀︿範鏂规硶
銆銆鍩瑰吇鑹濂戒範鎯
銆銆瑕佷粠楂樹竴绗涓鍫傚寲瀛﹁捐捣锛屽氨寤虹珛鍜屽潥鎸佸繀瑕佺殑瀛︿範甯歌勩傝惧墠鍋氬ソ棰勪範锛岃板ソ棰勪範绗旇帮紝绛斿ソ棰勪範鎬濊冮;涓婅句笓娉ㄥ惉璁诧紝鍋氬ソ鍚璇剧瑪璁帮紝鎻愰珮鍚璇炬晥鐜;璇惧悗鍙婃椂鍋氬︿範灏忕粨;鎸夋椂鐙绔嬪畬鎴愪綔涓氾紝鍙婃椂杩涜屽悇绉嶇煡璇嗘妧鑳界殑鎬荤粨锛屽綊绾崇瓫閫夎瘯鍗凤紝鏀堕泦缁忓吀濂介樹互鍙婂缓绔嬮敊棰樻湰銆傛敞閲嶇煡璇嗙殑鐞嗚В鍜岃繍鐢锛屽嫟鍔犵粌涔狅紝鍋氬埌鍠勪簬璐ㄧ枒銆傚︿範鏂拌炬椂瑕佹暍浜庤㈤棶锛屽湪鐭ヨ瘑鐨勪笂涓嬭仈绯绘瘮杈冧腑瑕佹暍浜庡彂闂锛屽湪鎬荤粨褰掔撼涓瑕佷笉鏂杩介棶銆
銆銆閲嶈嗗寲瀛﹀疄楠
銆銆鍖栧︽槸涓闂ㄤ互瀹為獙涓哄熀纭鐨勫︾戙傚寲瀛﹀疄楠屼负瀛︾敓褰㈡垚鍖栧︽傚康銆佹帉鎻″寲瀛︾悊璁烘彁渚涙劅鎬цよ瘑锛屽彲浠ユ湁鏁堝湴甯鍔╁︾敓妫楠屽拰宸╁浐鍖栧︾煡璇嗐佸寲瀛︽妧鑳斤紝鏈夊姪浜庡煿鍏诲︾敓瑙傚療鑳藉姏鍜屾濈淮鑳藉姏銆傚悓瀛︿滑搴旇ょ湡鐮旂┒姣忎釜瀹為獙鐨勭洰鐨勩佸師鐞嗭紝瀛︿範鍏蜂綋鎿嶄綔姝ラわ紝鍑嗙‘璁板綍瀹為獙鐜拌薄锛屽垎鏋愬緱鍑哄疄楠岀粨璁猴紝鍙婃椂瀹屾垚瀹為獙鎶ュ憡銆傚仛瀹為獙鏃惰仛绮句細绁炪佸嫟浜庡姩鎵嬨佽ょ湡瑙傚療銆佸杽浜庡姩鑴戙佺粌涔犵嫭绔嬭捐″疄楠屾柟妗堛
銆銆鑷鎴戝綊绾虫荤粨
銆銆棣栧厛锛屽強鏃舵荤粨銆傚仛鍒版瘡璇炬荤粨锛屾瘡鍛ㄦ荤粨锛屾瘡鍗曞厓鎬荤粨銆備竴涓鍗曞厓瀛︿範瀹屾瘯锛屾荤粨鍗曞厓閲嶈佺墿璐ㄦц川銆佸寲瀛︽柟绋嬪紡銆佺幇璞°佺敤閫斻佸瓨鍦ㄣ佸埗鍙栨柟娉曞拰閴村埆绛(濡傚厓绱犲寲鍚堢墿鍚勫崟鍏冪殑瀛︿範)銆傝嚜琛屾帹瀵肩浉鍏宠$畻鍏寮忥紝鎺ㄥ肩浉鍏冲彉鍖栬勫緥(濡傘婄墿璐ㄧ粨鏋勫厓绱犲懆鏈熷緥銆嬬煡璇嗙殑瀛︿範)銆傞氳繃鑷琛屾帹瀵硷紝瀵归噸鐐广佷富骞茬煡璇嗕綋绯诲皢鏈夋繁鍒昏よ瘑锛屼細寤虹珛璧疯壇濂界殑鍩虹鐭ヨ瘑銆

文章评论