南京大学郭少华AEM综述原子视角观测低温电解质的进展与问题
电化学储能(EES)技术的发展促进了电池供电电子设备的普及,使人们能够进入可持续和清洁的社会。除了便携式电子设备,可充电电化学储能设备在许多新领域也受到了更多关注,包括电动汽车、电网存储、太空探索、国防应用和海底作业。这些应用通常是在非常恶劣的工作环境中,这对电化学储能设备的性能要求更高,尤其是工作温度范围。例如,高海拔或高纬度环境所需的工作温度为−60°C,而在太空探索中温度可能低至−100°C。然而,严峻的现实是,即使是商业化较好的电池,其容量和速率性能在0°C以下也会迅速下降,在
研究背景
电化学储能(EES)技术的发展促进了电池供电电子设备的普及,使人们能够进入可持续和清洁的社会。除了便携式电子设备,可充电电化学储能设备在许多新领域也受到了更多关注,包括电动汽车、电网存储、太空探索、国防应用和海底作业。这些应用通常是在非常恶劣的工作环境中,这对电化学储能设备的性能要求更高,尤其是工作温度范围。例如,高海拔或高纬度环境所需的工作温度为−60°C,而在太空探索中温度可能低至−100°C。然而,严峻的现实是,即使是商业化较好的电池,其容量和速率性能在0°C以下也会迅速下降,在-20°C时几乎完全失效。如此糟糕的低温性能不足以满足北方寒冷冬季的日常生活,更不用说极端低温环境了。
为了确保电化学储能设备在运行期间的持续供电,已经开发了几种策略来优化其低温性能,包括热管理系统和电池优化。尽管效果显著,但热管理系统势必会增加电池组的重量和复杂性,并降低电池组的整体能效,从而丧失电池自身的优势。因此,最理想的策略是优化电池,尤其是电解质,这可以在不增加额外重量和成本的前提下提高低温性能。
众所周知,电化学储能器件工作原理的本质是阴极和阳极之间的离子迁移。当温度降低时,离子迁移减慢,电化学储能器件的容量保持和速率性能将不可避免地恶化。虽然优化电极材料,如开发有机电极和设计离子通道可以提高电池的低温性能,但效果有限。作为电化学储能器件中唯一的离子传输介质,电解质在低温下的粘度增加甚至凝固是离子迁移缓慢的主要原因。同时,电解质和电极之间的两相界面处的离子迁移也受到低温的限制。因此,实现高性能的关键是在低温下保持电解质处于液相和低粘度。
在过去的几十年中,人们在低温电解质的设计上付出了很多努力。低温电解质的研究涉及溶质盐、溶剂、添加剂、溶剂化结构表征和性能评估。鉴于低温电解质设计的关键作用和巨大成就,有许多集中与低温电解质的综述,但是,目前对低温电解质的研究仅仅集中于配方调节,而没有深入考虑电解质中的基本相互作用与其性能之间的关系。
内容简介
低温电解质的设计是提高电化学储能器件低温性能和拓展其应用领域的关键技术。然而,目前低温电解质的设计策略仍然停留在配方的优化上,没有系统和深入地考虑低温下电解质的基本相互作用和性能之间的内在关系。本文从电解质中阳离子、阴离子和溶剂之间的四种基本相互作用出发,首次从原子观点分析了它们相互作用的温度依赖机制以及电解质的相应物理化学性能,然后根据这些相互作用的关系,总结了低温电解质的研究进展,并指出了未来可能的新发展方向。相关成果以”Atomic Insights into Advances and Issues in Low-Temperature Electrolytes”为题发表在国际著名期刊Advanced Energy Materials上,文章的第一作者是Ruilin Hou,通讯作者是南京大学郭少华教授。
文章亮点
1. 第一次从原子的角度系统地分析了低温下电池中的缓慢离子迁移,揭示了低温电解质的低离子电导率、高粘度和高脱溶剂化能的原因。
2. 从调节四种基本相互作用的角度出发,总结了当前低温电解质的三种设计策略及其机制。指出了低温电解质的未来设计方向和思路,并分析了其可行性。
3. 总结了低温电解质发展的理论和技术挑战,并提出了相应的解决方案。
主要内容
一、原子视角分析低温电解质理化性能
典型的电解质主要由溶质(含电荷载体离子的盐晶体)和溶剂组成。当盐晶体溶解在溶剂中形成均匀的电解质时,离子/分子通过阳离子-溶剂、阳离子-阴离子、阴离子-溶剂和溶剂-溶剂相互作用,形成长程无序但短程有序的结构。其中,溶剂与溶剂的相互作用主要由范德华力和氢键引起,通常在室温下比其他相互作用弱得多。此外,由于阴离子的大半径和离域电荷以及质子型溶剂的罕见应用,阴离子与溶剂的相互作用较弱,因此在室温电解质中也常常被忽略。因此,对于当前的电解质研究,电解质中的阳离子-阴离子/溶剂相互作用受到了主要关注,这决定了溶剂化结构、阳离子扩散特性、电解质稳定性和电解质-电极界面性能,如图1a所示。
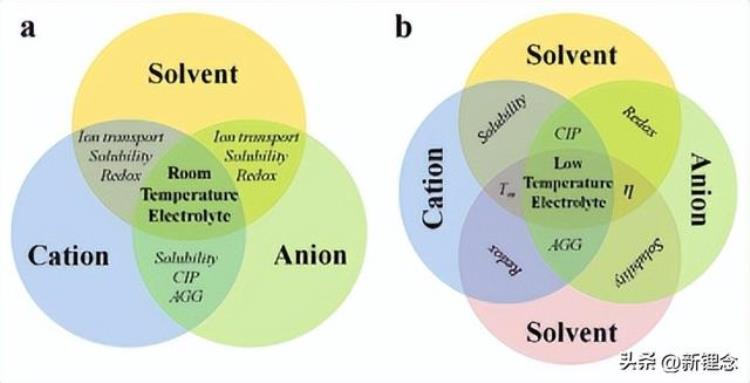
图1 分别在室温和低温电解质中的a)“三角形”和b)“四边形”基本相互作用示意图,以及相关的结构-功能关系。
最近,Ming等人首次揭示了特定电解质中的溶剂-溶剂相互作用在调节其溶剂化结构中也发挥了重要作用,从而实现了不同的离子动力学和电化学性能。为此,了解电解质中的基本相互作用对于高性能电解质的合理设计至关重要。
为了理解电解质的结构-活性关系,引入了经典物理模型来描述上述四种相互作用,这是因为它们都属于分子间力,包括离子-离子、离子-偶极和偶极-偶极力,尽管电解质中存在复杂的相互作用,在经典物理模型中,这三种力的势能可以用以下公式表示:
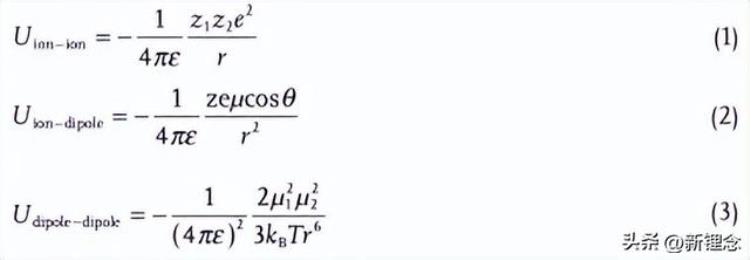
其中ε是介电常数,ze是离子的电荷,µ是偶极的偶极矩,r是离子或偶极中心之间的距离,θ是相对于连接离子和偶极中心的线的偶极角,kB是玻尔兹曼常数,T是绝对温度。上述三个公式仍然不能准确描述复杂的实际电解质结构,但它们为从原子角度定性半定量分析电解质相互作用提供了可靠的理论基础。
根据公式,离子(或偶极子)之间的相互作用与偶极子(离子)和离子(偶极子)中心之间的距离r有关。当温度降低时,分子热运动减弱,平均动能降低。因此,偶极(离子)中心之间的距离大大减小,相互作用增强。
此外,偶极-偶极相互作用比离子-离子和离子-偶极相互作用力对距离r(温度,T)更敏感,这也可以从公式中看出。值得注意的是,溶剂与溶剂的相互作用决定了熔点、沸点、介电常数和粘度。因此,对于低温电解质的研究,溶剂与溶剂的相互作用不能再被忽视,而应该是研究的重点之一。此外,在均匀电解质体系中,溶剂和溶质离子是统一的整体。换言之,随着温度降低,溶剂-溶剂相互作用的增强必然会影响其他几种相互作用,进而影响阳离子溶剂化结构、离子传输特性、电解质稳定性和电解质-电极界面性能。因此,如图1b所示,在设计低温电解质时,传统室温电解质中考虑的“三角形”阳离子-溶剂-阴离子相互作用应转化为“四边形”阳离子-溶液-阴离子-溶剂相互作用。下面,将通过“四边形”相互作用详细讨论低温电解质的发展困境。
1.1 低离子电导率
作为液体的重要物理性质,介电常数通常用来描述溶剂的极性,而溶剂的极性是用来评估其溶解度、粘度和电导率的。随着温度降低,溶剂的介电常数由于分子的缓慢流动而增加(图2a)。低温下较高的介电常数意味着更强的极性和溶剂-溶剂相互作用的增强,这严重限制了溶剂分子的迁移,导致粘度显著增加。例如,使用碳酸乙烯酯(EC)基电解质的锂离子电池(LIB)的低温性能较差,主要归因于其高粘度(40°C时为1.93 cP)和高冰点(36.5°C)。
如图2b所示,即使是低冰点二甘醇二甲醚(DEGDME)及其与1,3-二氧戊环(DOL)的混合溶剂,其粘度也随着温度的降低而显著增加。此外,随着温度的降低,离子-溶剂和离子-离子相互作用也增强,从而通过将溶剂和反离子与阳离子紧密结合而形成大的溶剂化离子簇。而电荷载体离子总是以溶剂化离子的形式在本体电解质中传输,因此,增加的溶剂粘度和大量的溶剂化电荷载体离子将不可避免地阻碍本体电解质中的离子传输。因此,电解质的离子电导率在低温下急剧下降(图2c),这直接导致电化学储能器件的容量显著下降。
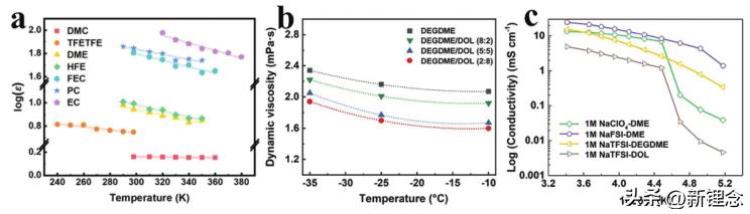
图2 温度对电解质物理化学性能的影响。a)溶剂的介电常数与温度的关系。b)典型电解质的动态粘度和c)离子电导率与温度的关系。
随着温度持续降低,更强的溶剂-溶剂相互作用也削弱了溶剂的溶剂化能力,导致盐晶体的溶解度降低。同时,低温也增强了阴阳离子的相互作用。结果,盐晶体在低温下开始沉淀。这样,电解质中电荷载体离子的浓度进一步降低,这将不可避免地进一步降低离子电导率。在温度降至电解质冰点以下之前,电解质几乎失去传输电荷载体离子的能力,电化学储能装置完全失效。事实上,在电解质完全固化之前,电化学储能装置的容量已降至0,这是因为冰点以上急剧降低的离子电导率使得离子传输速率不能满足储能的需求。
1.2高去溶剂化能
储能过程的本质是电荷载体离子和电极-电解质界面处的电极活性材料之间的相互作用,这涉及离子脱溶剂化和离子在固体电解质界面/阴极-电解质界面(SEI/CEI)膜上的扩散,如图3a所示。事实上,低温电解质的低离子电导率不是能量储存过程中离子传输的速率决定步骤。大量工作证明,SEI/CEI处的离子脱溶剂过程是界面离子传输过程中的主要能量消耗步骤。2016年,Janek的团队通过明确识别图3b所示的个体电阻贡献,证明去溶剂化过程具有高活化屏障。此外,Xu等人表明,即使不存在SEI/CEI膜,电池的低温性能(LTO//LTO)仍受到去溶剂化过程的限制。这项工作通过实验手段进一步分离了SEI/CEI膜内的离子去溶剂化过程和离子扩散,这为充分证明离子去溶剂过程是主要的速率决定步骤提供了更有说服力的证据。
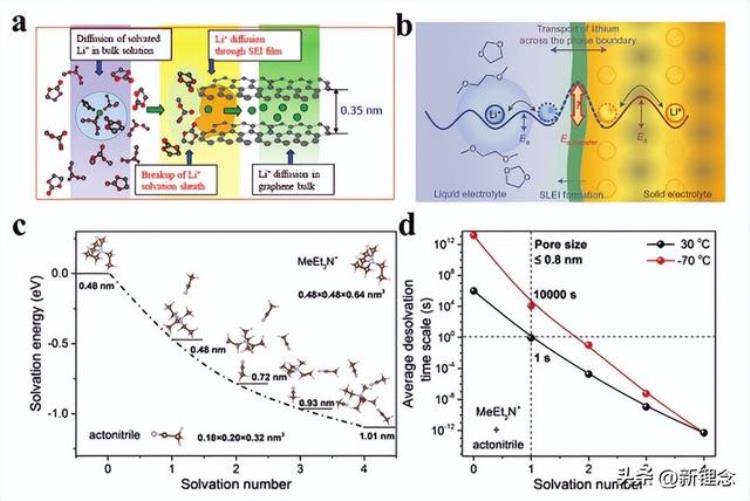
图3 温度对SEI膜脱溶剂过程的影响。a)电极-电解质界面的离子传输过程。b)溶剂化锂离子脱溶剂过程的高能势垒。c)ACN溶剂化离子的总溶剂化能和有效离子大小。d)不同溶剂化数的溶剂化离子的平均去溶剂化时间与温度的关系。
从原子的角度来看,所谓的离子去溶剂化过程是离子-溶剂/离子相互作用的去耦效应。如上所述,随着温度降低,阳离子溶剂化鞘中的离子-溶剂和阳离子-阴离子相互作用增强,这将增加溶剂化离子的去溶剂化能量,并使去溶剂化变得困难。例如,Gogotsi等人利用多孔碳材料的筛分效应研究了溶剂化离子的去溶剂化机理。结果表明,溶剂化离子的溶剂化能取决于其配位数(图3c)。配位数越低,溶剂化能越高,平均去溶剂化时间越长。这是因为溶剂分子的诱导偶极矩(µ)随着配位数的减少而增加,导致离子-溶剂相互作用的增强(式2)。此外,溶剂化离子的平均去溶剂化时间也随着温度降低(图3d)。简而言之,低温下离子/分子的有限热运动将使缓慢的去溶剂化过程更加困难。
1.3 SEI中的缓慢离子扩散
去溶剂化后,裸离子需要扩散穿过SEI/CEI膜以与电极相互作用。与液体电解质中的离子传输相比,低温下固相SEI/CEI膜中的离子扩散更困难。因此,提高SEI/CEI膜中的离子扩散速率对于优化电池的低温性能也很重要。目前,许多工作都集中在SEI膜上,但很少涉及CEI膜。尽管SEI膜中的离子传输是离子的固态扩散过程,这似乎与液体电解质无关,但SEI膜的组成和结构决定了离子扩散速率。具体而言,SEI膜是由初始循环过程中电极表面上的电解质分解形成的,其组成和结构直接取决于电解质中的离子/分子种类及其分解电势。
以1.0 m LiPF6 EC/DMC电解质中石墨电极上SEI膜的衍生过程为例,随着电势降低,痕量H2O、HF(由PF6−水解产生)、EC和碳酸锂开始逐渐还原分解,产生H2、LiF、有机锂盐产物、Li2O和气体(图4a)。通常,阴离子的分解有利于无机组分的形成,而有机溶剂的分解使有机组分更容易沉积在表面上。阴离子和有机溶剂的分解顺序不仅取决于电解质配方,还取决于其溶剂化结构。
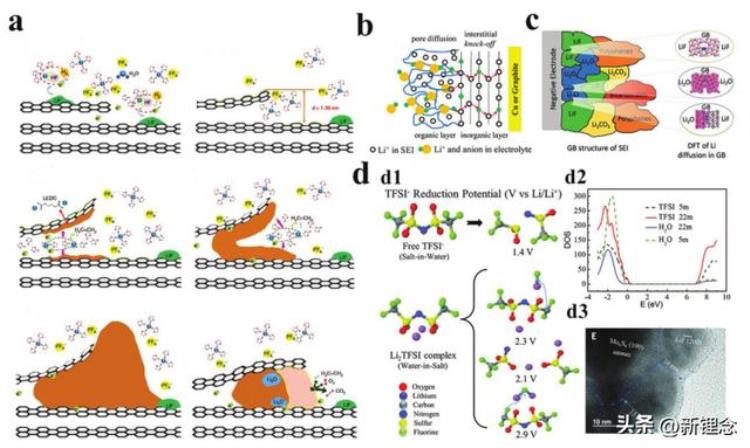
图4 SEI的形成机制和SEI中的离子扩散机制。a)第一次锂化过程中SEI膜形成的示意图。b)双层SEI膜中的Li 扩散路径。c)Li 倾向于在不同晶体的边界之间转换。d)电解质中的阴离子还原电位取决于离子浓度。d1)预测的阴离子还原电位。d2)H2O-LiTFSI电解质的预计状态密度。d3)循环Mo6S8的TEM图像。
一般来说,SEI内的离子传输机制类似于“类Grotthuss”的质子传导行为,通过无机组分的“敲击”路径(图4b)。与有机组分相比,无机组分具有更快的离子传输速率。理论计算结果表明,Li 通过SEI膜中无机组分(Li2O、LiF和Li2CO3)之间形成的晶界扩散,并具有快速的离子扩散速率(图4c)。这是因为无机Li2CO3和LiF之间的接触可以促进沿其晶界的空间电荷积累,并产生更高的离子载流子浓度。因此,富含无机的SEI膜是低温电化学储能器件的理想电极-电解质界面。
如上所述,SEI膜主要来源于电解质中溶剂和阴离子的还原分解。因此,可以通过改变溶质/溶剂的种类和离子溶剂化结构来调节SEI膜的成分和结构。为了确保低温下电池中的离子传输速率,理想的SEI/CEI膜应富含无机成分,薄且紧密。为此,电解质优选具有氟溶剂/阴离子,其溶剂化结构由接触离子对(CIPs,强离子-离子相互作用)主导。例如,典型的盐包水电解质(21m)中的Li -TFSI−相互作用导致TFSI−的还原电位显著增加,导致富LiF的SEI膜的衍生。
除了调整电解质配方外,低温也会影响SEI的成分和结构。首先,温度是影响溶剂化结构的主要原因。当温度降低时,溶剂与溶剂的相互作用急剧增加,导致电解质的粘度增加。同时,更强的溶剂-溶剂相互作用意味着溶剂-离子相互作用将减弱,从而降低溶剂对盐的溶解度。因此,电解质中的阳离子-阴离子相互作用将更强,这可以通过电解质在低温下的盐析现象充分证明。
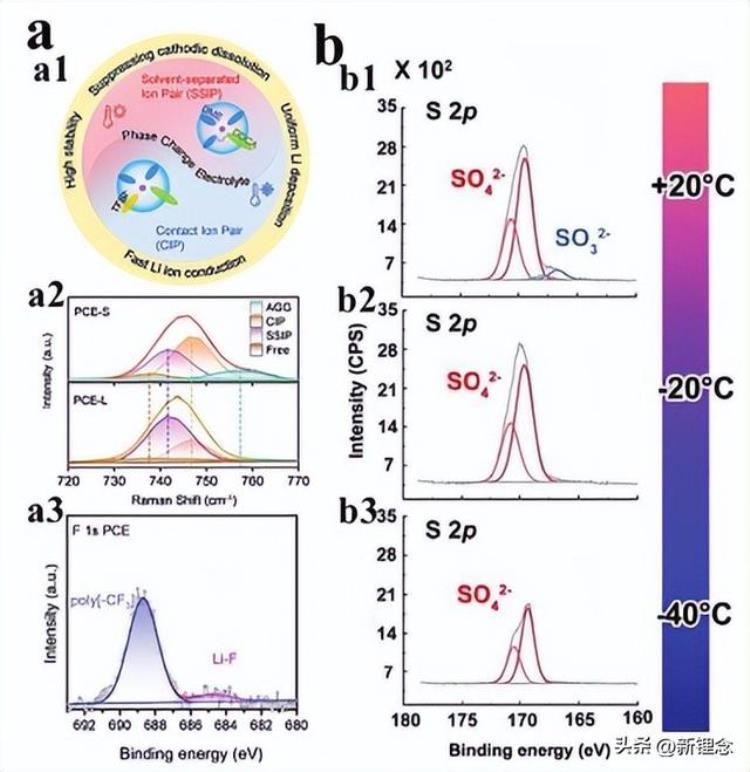
图5 温度对SEI膜溶剂化结构和组分的影响。a)阳离子溶剂化结构与温度的关系。a1)相变电解质和相应溶剂化结构的示意图。a2)液相和固相中TFSI配位的拉曼拟合结果。a3)Cu箔上SEI的F1s光谱的XPS。b)SEI膜的有机成分分别为b1)20°C、b2)−20°C和b3)−40°C。
在盐析之前,低温驱动的强阴阳离子相互作用促进了更多CIPs的形成,这无疑会导致优先阴离子分解形成富含无机物的SEI。例如,Li等人报道,随着温度降低,电解质的溶剂化结构从溶剂分离离子对(SSIP)变为CIP,拉曼光谱证明了这一点(图5a1,a2)。然后,阳离子-阴离子的强相互作用促进了阳极表面阴离子的还原电位,导致SEI膜含有LiF(图5a3)。第二,生成SEI膜的化学反应的发生电位和反应速率也严重依赖于温度,反应活化能与温度之间的关系遵循阿伦尼乌斯公式。
在低温下,溶剂/阴离子还原分解的活化能增加,这导致溶剂分解不足,导致SEI膜中的成分和厚度发生变化。例如,在NaOTf基电解质中,初生SEI膜中没有具有较低氧化态的物种(图5b),这表明电解质和Na金属之间的寄生反应在低温下受到抑制。
总之,慢离子传输动力学是限制电化学储能器件低温性能的主要原因。本质原因是低温下电解质中离子/溶剂相互作用的变化,特别是溶剂-溶剂相互作用显著增强。因此,通过调整电解质组分,在溶剂-离子-溶剂的“四边形”关系中寻求平衡是实现低温设计和优化电池低温性能的关键。
二、低温电解质设计机理
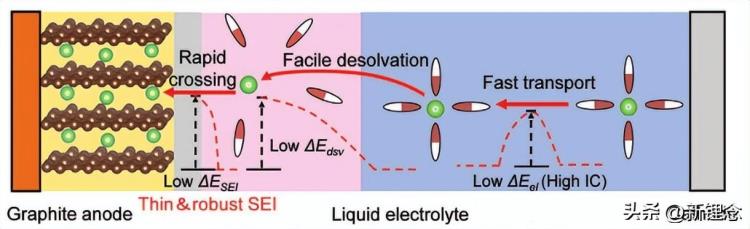
图6 理想低温电解质的快速离子传输示意图,包括在本体电解质中的快速离子输送、易脱溶剂化和离子快速穿过SEI膜。
根据先前的分析,低温下电池中缓慢的离子扩散过程是其低温性能差的原因,这涉及到本体电解质中的缓慢离子传输、界面处的离子脱溶剂化困难以及SEI膜中缓慢的离子扩散。在原子水平上,缓慢的离子扩散主要是由于在低温下溶剂-溶剂相互作用的显著增强。相应地,离子-溶剂和离子-离子相互作用的增强也对本体电解质中的离子传输产生不利影响。溶剂化离子的脱溶剂能和SEI膜的结构/成分分别与离子-溶剂和阳离子-阴离子相互作用有关。此外,应强调的是,在均匀电解质中,阴离子、阳离子和溶剂之间的“四边形”相互作用相互制约。因此,通过改变其中一个交互作用,其他三个交互作用将被“诱导”改变。因此,调整离子-溶剂相互作用、离子-离子相互作用和溶剂-溶剂相互影响以减轻低温造成的不利影响是低温电解质设计的核心。
理想的低温电解质应具有高的离子传输动力学,包括离子在本体电解质中的快速传输、容易脱溶剂化和SEI膜内的离子快速传输(图6),以确保电池在低温下保持高性能。这需要具有高电荷载体离子浓度(强离子-溶剂相互作用)、低粘度(弱溶剂-溶剂相互影响)、快速脱溶剂过程(弱离子-溶剂交互作用)和富含无机SEI膜的成膜能力(强阳离子-阴离子相互作用)的电解质。目前,虽然使用了多种策略来优化电解质的低温性能,但它们基本上是在调整四种基本的相互作用,以下将从原子层面分析低温电解质的设计机制。
2.1 弱溶剂-溶剂相互作用
低温电解质设计的最终目标是确保电解质在低温下保持液态并具有高离子电导率。因此,低温电解质的主要设计策略是选择低冰点和低粘度的溶剂作为电解质的溶剂。从原子的角度来看,电解质在低温下的粘度增加或冻结是由于溶剂-溶剂相互作用的增强。因此,优化电解质配方以破坏或削弱溶剂-溶剂的相互作用可以有效地降低电解质在低温下的粘度或冰点。
首先,溶剂的选择对于低温电解质的设计非常重要。理想的低温电解质溶剂应具有较强的溶解度和较低的凝固点。具体而言,确保盐晶体在低温下在溶剂中的充分溶解度是获得具有高离子电导率的低温电解质的前提。事实上,盐晶体在溶剂中的溶解度取决于离子与溶剂的相互作用。就特定的盐晶体而言,其溶解度取决于所选溶剂的极性,这可以通过溶剂的介电常数来反映。为了提高盐晶体在溶剂中的溶解度,经常使用具有高极性的溶剂。然而,高极性(介电常数)也意味着强烈的溶剂-溶剂相互作用,导致高冰点和较差的低温溶解能力。
例如,EC对常见的锂盐和钠盐具有良好的溶解性,并且由于其高的介电常数被用作LIB/SIB的主要溶剂,然而,其高冰点极大地限制了含EC电解质的低温应用。此外,高极性水也是盐晶体的良好溶剂,但水分子之间的强氢键力使水电解质在低温下容易盐析或固化。如图7a所示,虽然没有明确的函数关系,但通常介电常数越高,溶剂的粘度越高,凝固点也越高。值得注意的是,在最新的研究中,介电常数仅反映了纯溶剂的极性,但不能代表离子的可溶解性及其与共溶剂的混溶性。因此,低温电解质的溶剂可以通过介电常数初步筛选,但其可溶解性和冰点需要通过实验进一步确认。然而,为了追求低冰点而盲目选择低介电常数的溶剂也是不可行的。
例如,Meng等人使用液化气体作为溶剂,包括氟甲烷(FM)和二氟甲烷(DFM),其介电常数显著低于普通溶剂。尽管液化气体电解质在低温下达到了低冰点和低粘度,但其LiTFSI的溶解度也很低(小于0.1m)。为了提高盐的溶解度,液化气体电解质必须与其他具有高介电常数的共溶剂一起使用,如四氢呋喃(THF)和乙腈(AN)。因此,根据图7a,一些具有高溶解度和低冰点的溶剂,包括碳酸丙烯酯(PC)、AN和甲酸甲酯(MF),可以被选为低温电解质的主要溶剂。
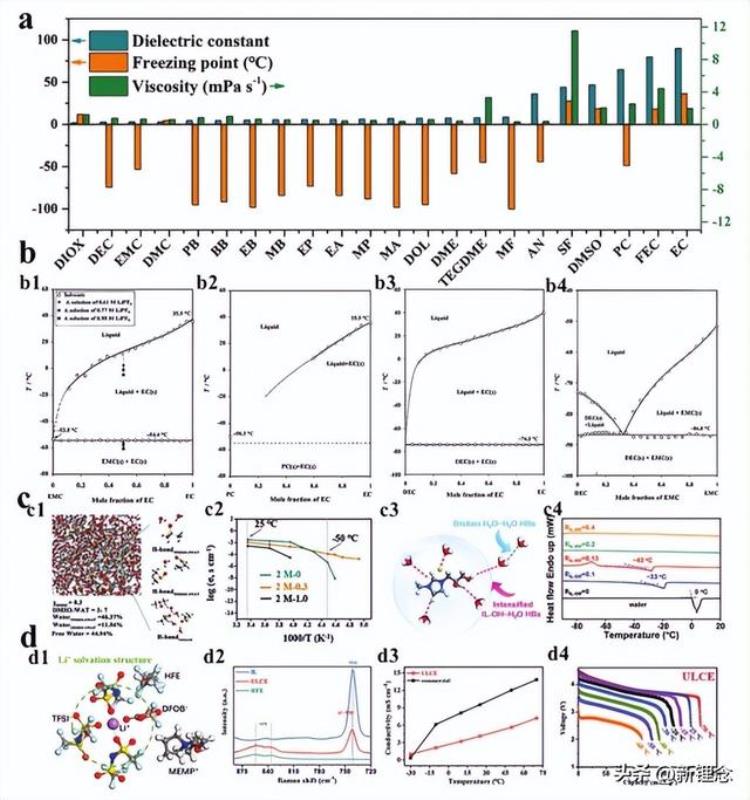
图7 通过削弱溶剂-溶剂相互作用设计低温电解质。a)低温电解质所用溶剂的物理性能比较。b)引入低冰点共溶剂。b1)EC-EMC混合物、b2)EC-PC混合物、b3)EC-DEC混合物和b4)DEC-EMC混合物的典型二元相图。c)引入含羟基添加剂。来自MD模拟的含有DMSO作为添加剂的水性电解质的构象分析c1)及其温度依赖性离子电导率c2)。c3)IL-OH和水之间相互作用的示意图。c4)纯水和具有不同RIL-OH的电解质溶剂的DSC。d)引入稀释剂。d1)LHCE的典型Li 溶剂化结构。d2)HFF、IL和LHCE的拉曼光谱。d3)LHCE和商用电解质在不同温度下的离子电导率。d4)LHCE中NCM622/Li电池在不同温度下的放电曲线。
与非质子有机溶剂不同,水分子既可以用作电子受体,也可以用作电子供体。因此,另一种削弱水-水相互作用并改善水电解质低温性能的策略是添加多羟基溶剂。当将多羟基溶剂添加到含水电解质中时,水分子和羟基之间可以形成氢键,从而破坏水之间的氢键网络并抑制水冻结。例如,当将摩尔分数为0.3的二甲基亚砜(DMSO)添加到2 m NaClO4水性电解质中时,DMSO和水分子之间稳定地形成氢键,如图7c1所示。然后,电解质在-50°C时表现出-130°C的超低冰点和0.11 mS cm−1的充分离子电导率(图7c2)。使用这种电解质的钠离子混合电容器可以在-50°C下正常工作,比容量为68 mAh g−1,是其室温容量的61%。根据相同的机理,其他多羟基化合物也被添加到含水电解质中,并获得了优异的低温性能,包括乙二醇、甘油、乙醇、甲醇、丙二醇、环丁砜、和丁二腈。
除有机溶剂外,还将多羟基聚合物引入水性电解质中,以通过形成氢键抑制冰晶的形成。例如,聚丙烯酰胺(PAM)、聚乙烯醇(PVA)、聚丙烯酸、聚SH、聚两性电解质和定向凝胶。此外,受上述机制启发,开发了一种新型羟基官能团聚合物(离子液体),并将其应用于水性电极,导致-80°C的低冰点(图7c3,c4)。水性锂离子电池在−80°C下的容量为43 mAh g−1,循环稳定性超过200次。事实上,尽管聚合物具有较大的分子量,但它们仍然参与阳离子溶剂化结构并发挥溶剂的作用。因此,在水性电解质中添加多羟基溶剂/聚合物可以被视为通过增强主溶剂-共溶剂相互作用来削弱主溶剂之间相互作用的策略。
无论是添加共溶剂还是多羟基溶剂/聚合物,其本质都是在低温下削弱主要溶剂之间的相互作用,并克服主要溶剂在低温下的失效。因此,它们更适合于以溶剂为主要成分的稀电解质。然而,对于高浓度电解质,强的阳离子-阴离子和阳离子-溶剂相互作用使得离子迁移困难。它们在低温下容易盐析,导致载流子离子的急剧减少。通常,添加助溶剂是解决上述问题的有效方法。
然而,共溶剂会参与离子溶剂化结构,破坏高浓度电解质的电化学稳定性和优异的SEI膜形成能力。因此,选择非极性或非极性溶剂来稀释高浓度电解质并保持其溶剂化结构不变。例如,在用1,1,2,2-四氟乙基-2,2,3,3-四氟丙醚(HFE)稀释后,拉曼光谱表明高浓度电解质的溶剂化结构保持不变(图7d2)。然后,溶剂化离子团均匀分散在稀释剂中,形成局部高浓度电解质(LHCE),如图7d1所示。该LHCE在低温和≈-60–70°C的宽工作温度下表现出高离子电导率(Figure 7d3,d4)。锂金属电池(NCM622/Li)即使在-60°C下也显示出115 mAh g−1的高容量,为室温容量的57%。
与上述共溶剂(其分离了本体电解质中主要溶剂分子的空间距离)不同,LHCE通过稀释剂增加了本体电解质中溶剂化簇的距离。然而,高度氟化的稀释剂通常具有高成本。因此,使用稀释剂优化低温性能的策略更适用于高浓度电解质。
2.2 增强离子与溶剂的相互作用
在同类电解质中,溶剂分子的性能也受到与其相互作用的离子的影响。因此,从理论上讲,通过增强离子与溶剂的相互作用来调节电解质的低温性能是可行的。从电解质结构的角度来看,浓度的增加导致电解质中盐/溶剂摩尔比的增加,这促使更多的溶剂分子参与离子溶剂化结构。强烈的离子-溶剂相互作用的广泛形成必然会削弱溶剂-溶剂的相互作用,这将在低温下破坏溶剂分子之间的重排和强相互作用,并降低冰点。以水性电解质为例,随着电解质中离子浓度的增加,离子-水相互作用增强,水分子之间的氢键网络断裂。因此,水分子之间的氢键网络无法有效形成,从而抑制了冰的成核。事实上,电解质的冰点是依数的,这是一种固有的性质,取决于溶剂和溶质的比例。电解液的冰点降低可通过以下公式计算:
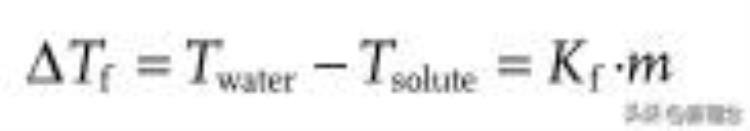
式中,ΔTf为冰点下降;Twater是水的热力学冰点(0°C);Tsolute是溶质的冰点,Kf是冰点下降常数(水为1.86°C kg mol-1);m是阴离子和阳离子的总摩尔数。显然,随着浓度的增加,电解质的冰点降低,因此,高浓度电解质是典型的低温电解质。例如,在高浓度ZnCl2电解质中,强离子-溶剂相互作用可以有效地调节电解质的氢键网络结构,并抑制水的冻结(图8a1,a2)。当浓度为7.5 m时,ZnCl2水电解质达到最低冰点,并在≈-100-60°C的范围内保持高离子电导率(图8a3,a4)。聚苯胺锌电池在-70°C时达到84.9 mAh g−1的高比容量。采用相同的机理,其他高浓度电解质,包括22 m KOTf、16 m LiCl、21 m LiTFSI、40 m KOAc 9.8 m LiOAc、和1 m Zn(CF3SO3)2 21 m LiTFI也用作低温电解质,并获得了良好的性能。
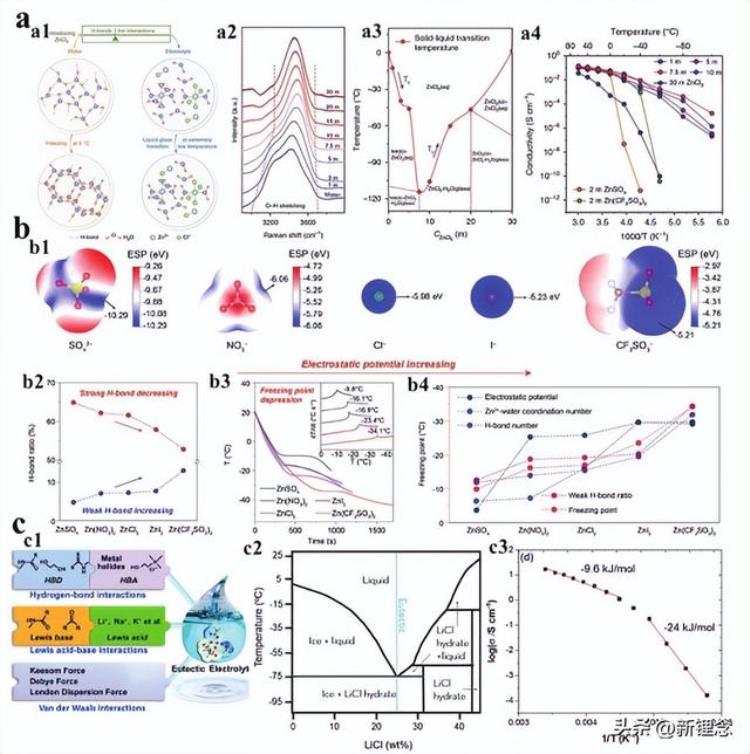
图8 通过增强离子-溶剂相互作用设计低温电解质。a)阳离子-溶剂相互作用。a1)随着温度降低,水和HCE电解质的结构演变示意图。a2)不同浓度电解质的O-H的拉伸振动。a3)ZnCl2电解质的相图。a4)不同Zn2 基电解质的离子电导率与温度的关系。b)阴离子-溶剂相互作用。b1)不同阴离子的ESP映射。b2)电解质中具有强氢键和弱氢键的水的比例。b3)电解质的逐渐冷却曲线和相应冰点(插图)。b4)上述特征之间的相关性总结。c)深共晶电解质。c1)共晶电解质的形成机制。2)LiCl-H2O相图。在24.8%LiCl时,电解液的冰点为−74°C。c3)温度传导数据的Arrhenius图。
通常,金属阳离子由于其高电荷密度,主要负责破坏高浓度水电解质中的氢键网络。然而,阴离子在调节含水电解质冰点方面的重要作用不容忽视。一方面,阴阳离子相互作用的强度直接决定了阳离子对水分子间氢键网络的破坏能力。如图8b1,b2所示,随着阴离子静电势的增加,水分子之间的强氢键显著减少,导致冰点降低。这是因为具有较高静电势的阴离子与阳离子的相互作用较弱,这将减少阴离子配位对阳离子破坏氢键网络的不利影响(图8b4)。锌(CF3SO3)2电解质的Zn||V2O5电池在−30°C时提供285.0 mAh g−1的高放电容量。
另一方面,可以与水分子形成强氢键的阴离子也可以抑制水电解质的冻结。与阳离子的作用类似,强的阴离子-溶剂相互作用也可以在破坏水分子之间的氢键网络方面发挥重要作用,从而降低水电解质的冰点。目前,一系列阴离子,包括Cl-、SO4-、ClO4-、和BF4-已被证明在低温下具有良好的防冻效果。其中,使用酸性电解质的质子电池表现出特别优异的低温性能。除了阴离子在抑制冻结中的作用外,小半径电荷载体氢离子(质子)及其与有机电极的相容性也是即使在-90°C的低温下也具有优异动力学的重要原因。
具有强离子-溶剂相互作用的更典型的电解质是共晶电解质。所谓共晶溶液是指共晶溶液的凝固点远低于用于形成共晶的每种成分的凝固点。只有当不同组分的分子间相互作用大于每种组分单独的原始相互作用时,才能形成共晶电解质。通常,共晶电解质主要通过三种相互作用形成,包括氢键、路易斯酸碱和范德华力(图8c1)。从分子/离子相互作用的角度来看,共晶电解质的形成是多组分之间相互作用重建的结果。
简而言之,当两种组分混合时,通过上述强大的力形成离子-溶剂相互作用,这比原始盐晶体中的阴离子-阳离子相互作用和溶剂中的溶剂-溶剂相互作用力都强。因此,由强离子-溶剂相互作用形成的均匀共晶相的熔点低于每个原始组分。通过选择具有本征低熔点的组分或调整组分的混合比,可以增强分子间相互作用并进一步降低共晶温度。例如,以水为路易斯碱,以碱金属离子(Li )为路易斯酸,24.8%的LiCl形成凝固点为-74°C的共晶,并在高于-70°C的温度下实现高离子电导率(图8c2,c3)。目前,已报道了一系列低温共晶电解质,包括Zn(TFSI)2-H2O、LiTFSI-H2O、Mg(ClO4)2-H2O和Zn(ClO4)2-H2O-SL。
需要强调的是,水电解质中离子和H2O分子之间的基本相互作用复杂多样。以典型的低温含水电解质7.5 m ZnCl2为例,从内部相互作用的角度来看,它通过阳离子-溶剂和阴离子-溶剂相互作用抑制冻结。从电解质分类的角度来看,它可以被视为高浓度电解质或由路易斯酸碱相互作用构建的共晶电解质。尽管水性电解质中的复杂相互作用可能会导致理解混乱,多重相互作用也为设计新型低浓度低温电解质提供了机会。
此外,值得注意的是,通过增强离子-溶剂相互作用来优化电解质低温性能的策略强烈依赖于离子浓度。然而,电解质中的高盐/溶剂摩尔比也导致电解质在低温下的低离子电导率。为此,应进一步降低高浓度电解质和共晶电解质的粘度,并在此过程中保持强离子-主溶剂相互作用。目前,虽然通过添加稀释剂可以有效地解决上述问题,但其高成本极大地限制了其应用。因此,获得极低的固-液转变温度是在高浓度/共晶电解质中适当平衡离子-溶剂和离子-离子相互作用强度的关键。
2.3 增强离子–离子相互作用
在低温下,电极-电解质界面处的缓慢离子迁移涉及溶剂化离子的脱溶剂化和SEI膜中的缓慢离子扩散。前者是由强离子-溶剂相互作用引起的,而后者由SEI的成分和结构决定。如上所述,SEI膜中无机组分含量的增加有利于离子扩散,离子扩散主要由电解质中阴离子的还原形成。为此,有必要通过调整电解质来优化SEI膜的成分。
如前所述,CIPs的溶剂化结构有利于形成富含无机的SEI膜,这可以实现快速的离子扩散。尽管高浓度电解质和LHCE都可以实现强离子-离子相互作用(CIPs)并形成富含无机物的SEI膜,但它们的离子-溶剂相互作用也增强了,这大大限制了去溶剂化过程。因此,为了加速穿过SEI的离子传输速率,必须实现增强的离子-离子相互作用和减弱的离子-溶剂相互作用。
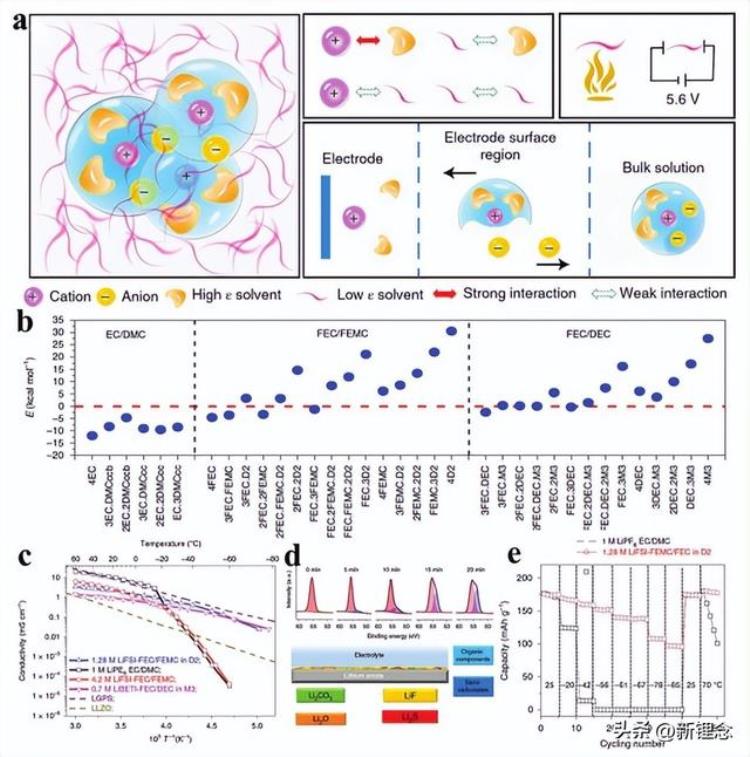
图9 通过增强离子-离子相互作用设计低温电解质。a)弱溶剂化电解质的设计策略和性能。b)计算了不同结构的Li 溶剂化/去溶剂化能。c)液体和固体电解质的电导率。d)使用1.28m LiFSI FEC/FEMC-D2电解质的循环锂金属阳极的XPS Li 1s光谱及其SEI层的示意图。e)NCA//Li电池在不同温度下使用不同电解质的容量。
根据上述分析,弱溶剂化电解质是理想的低温电解质(图9a)。首先,弱离子-溶剂相互作用降低了溶剂化电荷载体离子的去溶剂化势垒,实现了更快的去溶剂过程。该过程是低温下离子转移的主要速率决定步骤。第二,弱离子-溶剂相互作用意味着溶剂解离盐晶体的能力有限,这使得电解质中的阴离子更有可能参与电荷载体离子的溶剂化结构。
由此产生的强阳离子-阴离子相互作用促进阴离子的优先还原,以形成富含无机的SEI膜,这加速了SEI膜中的离子扩散。最后,低极性溶剂具有弱的溶剂-溶剂相互作用,这使其具有低冰点和低粘度。目前,设计弱溶剂化电解质的策略主要依赖于筛选或合成弱溶剂化溶剂。
例如,与常规碳酸盐电解质(EC/DMC)相比,FEC/FEMC或FEC/DEC中Li 的溶剂化能更低。在进一步引入非极性溶剂D2或M3后,溶剂化能已降低到正值(图9b),表明该相互作用在能量上不利于离子-溶剂相互作用。由于弱的离子-溶剂相互作用(低溶剂化能),所设计电解质的离子电导率仍>0.01 mS cm−1(图9c)。同时,由于增强的阳离子-阴离子相互作用,设计的电解质可以衍生成富含LiF的SEI膜(图9d)。使用设计电解液的电池即使在−85°C温度下也能实现约50%的高室温容量(图9e)。
目前,弱溶剂化电解质由于其对富含无机的SEI膜具有优异的衍生能力,已成为高压低温电解质的新研究方向。筛选了一系列弱溶剂化的溶剂,并将其应用于电解质的开发,包括TEP、DEE、DMM、1,3-DX、DMSi。事实上,弱溶剂化电解质是离子-溶剂和阳离子-阴离子相互作用之间的配位效应。因此,弱溶剂化电解质不仅可以通过调节溶剂,也可以通过调节阴离子来构建。例如,Li等人通过将LiBF4溶解在DME/FEC混合溶剂中,成功构建了弱溶剂化电解质。这是因为LiBF4在各种常见锂盐中具有最小的解离度。因此,在LiBF4电解质中Li 的溶剂化结构中,BF4-阴离子而非溶剂在电荷屏蔽中起主要作用。
作为补充,添加剂也被证明在阳极表面分解并形成富含无机的SEI膜,这促进了低温下的离子扩散。通常,电解质中添加剂的含量至多为5%(wt%或vol%)。因此,添加剂对电解质溶剂化结构的影响非常微弱,它们主要用作SEI膜形成的牺牲剂。已经开发了多种添加剂并将其用于商业电解质中以改善低温性能,例如AS、DMS、PhMS、CMDO、TMSP、PCS、PDMS、Li2CO3、LiPO2F2和LiDFOB。
总之,理想的低温电解质应具有高离子电导率、低粘度、低去溶剂化能,并在低温下形成薄且坚固的富含无机成分的SEI膜。从原子的角度来看,电解质需要具有以下特征。
1) 强溶剂-离子相互作用,确保高盐晶体溶解度,这是实现高离子电导率的前提。
2) 弱溶剂-溶剂相互作用,是实现低粘度和低冰点的关键。
3) 强烈的离子-离子相互作用,促进界面阴离子的优先还原,形成富含无机成分的SEI膜。
4) 弱离子-溶剂和离子-离子相互作用,它们降低了SEI膜上的去溶剂化屏障。
显然,低温电解质中对四种基本相互作用的要求是多重的,甚至是矛盾的。可以预测,任何单一溶剂和盐晶体的组合都不能同时满足上述四个要求。因此,构建低温电解质的最终策略将集中于设计电解质组分并调整其比例,从而实现四种相互作用的平衡。
三、低温电解质的未来研究方向
未来,低温电解质的发展仍将遵循上述原则,以更好地平衡四种基本相互作用。更系统深入的机理研究将有助于优化高性能低温电解质。此外,低温电解质的设计不应局限于成分/比率的“试错”调整,而应进一步扩展到更多方向。
3.1 高熵电解质是未来之路
单溶剂电解质的性能限制远远不能满足低温电解质甚至室温电解质的性能要求。因此,常用的电解质大多是二元溶剂由高极性环状溶剂和低极性线性溶剂的混合物组成。通常,二元溶剂基电解质具有比单溶剂基电解质高得多的电导率。因此可以推断,随着溶剂种类的增加,电解质的低温性能将进一步优化。例如,LiPF6在单(EC)、二元(EC/EMC)和三元(EC/DMC/MB)溶剂中的电荷转移活化能分别为71.10、67.74和56.34KJ mol−1。显然,随着溶剂的增加,电解质更容易获得高电导率,这在理论上有利于优化低温性能。
此外,通过将不同的盐晶体溶解在同一溶剂中获得的电解质的离子电导率不同,因为阴离子和阳离子之间的结合能不同。理论上,多组分(盐和溶剂)混合溶剂作为电解质溶剂具有以下优点。首先,均匀分布在本体电解质中的各种溶剂可以成为彼此的物理“屏障”,这可以降低相同溶剂的分子间作用力,这样,可以降低电解质的粘度并改善其低温性能。其次,各种溶剂分子的介电常数、极性和稳定性不同,可以实现物理和化学性能的互补。例如,高熵电解质的设计应同时考虑弱溶剂化、高溶解度和优异的还原/氧化稳定性。因此,开发具有五种以上有机溶剂的“高熵”电解质对于常规电解质和低温电解质都具有重要的研究价值。
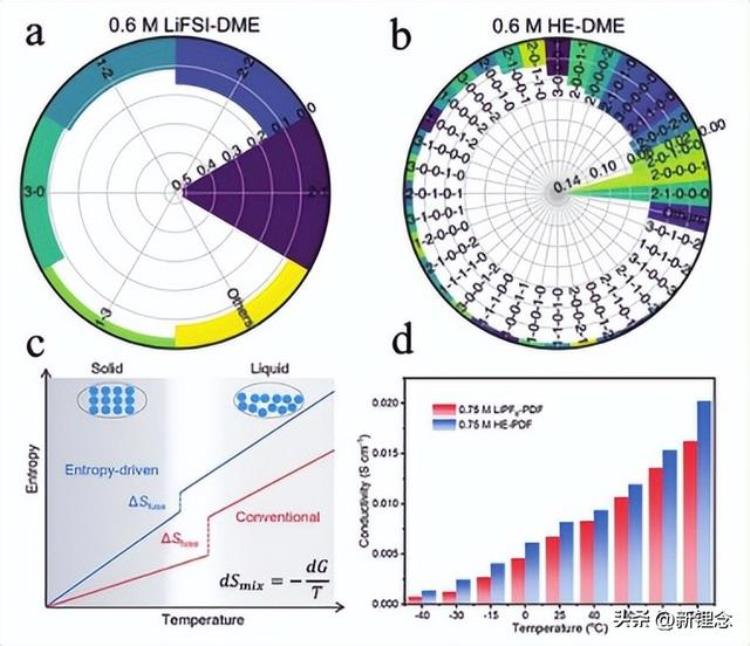
图10 高熵电解质的设计。a)0.6 m LiFSI DME电解质和b)0.6 m HE-DME电解质的锂离子配位环境由MD模拟确定。c)相变过程中熵随温度变化的示意图。d)0.75 m LiPF6 PDF和0.75 m HE-PDF电解质在不同温度下的离子电导率。
崔等人首先提出并设计了具有高离子电导率的EL5高熵电解质(1 m LiFSI DME-DEE-DEEGDME-TE-BTFE),这是因为较高的混合熵产生了较小的离子簇。类似地,赵和合著者通过引入多种盐设计了高熵电解质。与相同浓度的单盐电解质(0.6 m LiFSIDME)相比(图10a),高熵电解质0.6 m HE-DME(0.15 m LiFSI/0.15 m LiTFSI/0.15 m LiDFOB/0.15 m LiNO3在DME中)有30多种类型的锂离子溶剂化环境(图10b),导致高离子电导率。同时,增加的熵可以降低电解质的吉布斯自由能,从而降低电解质的冰点,如图10c所示。
高熵电解质(0.75 m HE-PDF:0.15 m LiPF6/0.15 m LiFSI/0.15 m LiTFSI/0.15 m LiDFOB/0.15 m LiNO3,PC/DEC中,含5�C)即使在-40°C的低温下也显示出较高的电导率(图10d)。最近,Wang等人通过向ZnCl2电解质中引入LiCl,将[ZnCl4–m2–m]n离子网络(n>3)分解为各种离子簇,成功设计了高熵水电解质。使用上述电解质的锌空气电池可在-60°C和 80°C之间运行。
需要强调的是,所谓的“高熵”电解质并不仅仅是多种有机溶剂的“叠加”。可以预见,对于高熵电解质的溶剂选择,应该有以下基本要求:
1)各种溶剂可获得良好的混溶性并形成均匀的混合液体。
2) 各种溶剂应在物理和化学财产上具有明显的优势,并能相互补充各自的缺点,以获得优异的综合性能。
3) 高熵混合溶剂应具有一定的溶解度,以确保良好的离子迁移速率。
3.2 低温凝固不是终点
与具有一定凝固点的纯溶剂不同,随着温度的降低,混合电解质的溶剂固化和盐析不是同步的,并且取决于电解质的配方。通常,盐析和溶剂固化都被认为是电解质的低温失效。具体而言,当盐析优先发生时,盐晶体在电解质中的溶解度降低,离子电导率迅速降低。当优先发生溶剂固化时,离子传输模式从相对快速的液相传输转变为缓慢的固相传输,并且离子电导率也快速下降。然而,目前的文献报道表明,电解质的固化并不等于其完全失效。
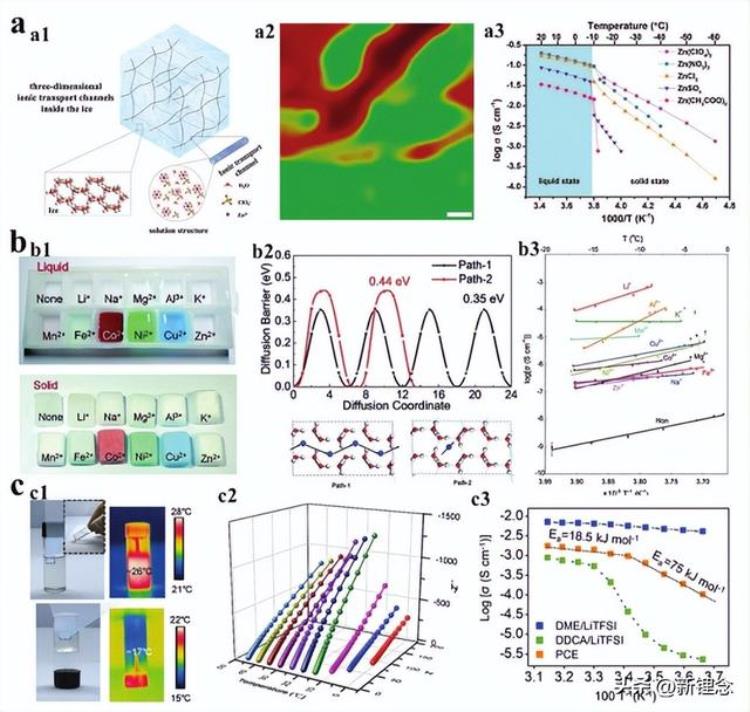
图11 低温电解质穿过固相和液相。a)冰中的高浓度盐通道。a1)Zn(ClO4)2盐水中离子传输机制示意图。a2)如果Zn(ClO4)2在−30°C下结冰,则拉曼光谱图。绿色和红色分别代表冰和浓缩Zn(ClO4)2溶液。a3)溶液和相应的盐冰在不同温度下的离子电导率。经许可复制。b)冰作为固态低温电解质。b1)制造从11种不同类型阳离子的硫酸盐溶液冻结的超纯冰和ICI。用液体N2从相应的溶液中冷冻样品。b2)两种可能的Cu2 传导路径中扩散势垒的DFT计算。b3)ICI中不同离子的Arrhenius离子电导率图。c)相变电解质。c1)照片和红外图像显示了固态和液态PCE的物理状态和本体温度。c2)0至45°C的不锈钢/PCE/不锈钢电池的EIS。c3)0至45°C时PCE和DDCA LiTFSI、DMELiTFSI的离子电导率的温度依赖性。
首先,由于电解质的非均匀凝固,在固相中存在高浓度电解质离子通道。如图11a1所示,当Zn(ClO4)2水电解质在低温下固化时,不完全固化的高浓度电解质通道由冰中的盐析出形成。基于O的差异H拉伸液态水和冰的振动模式,拉曼映射直接表明固态冰中存在液态浓缩盐通道(图11a2)。由于这种3D离子传输通道的存在,Zn(ClO4)2电解质即使在−60°C下也保持了1.3 mS cm−1的优异离子电导率(图11a3)。事实上,在海冰形成过程中形成盐水通道是非常常见的。因此,特殊的水性电解质可以在超过其冰点的温度范围内工作。
第二,特定离子在快速冷却的电解质(均匀凝固)中具有一定的传输能力。受固态电解质的启发,Wu等人发现,Cu2 在冰中的两个扩散路径中的扩散激活能与某些固态电解质的扩散激活能量相当,证明了冰晶具有作为固态电解质的潜力(Figure 11b2)。如图11b1所示,为了抑制冻结过程中的溶质沉淀或分离,他们通过在液氮中快速冻结盐水溶液来制备离子传导冰(ICI)。在−20至−5°C的不同温度下,从不同硫酸盐溶液中冷冻的ICI的离子电导率约为10−7–10−3 S cm−1(图11b3)。这项工作证明,这种特殊的盐冰结构具有输送离子的能力,可以用作固体电解质。
第三,即使在固化后,特殊溶剂仍具有良好的离子传输速率。例如,Li等人通过筛选高熔点(>15°C)溶剂十二烷二酸二甲酯(DDCA)构建了相变电解质,其可在22°C时可逆地改变物理状态(图11c1)。在相变点附近,电解质的离子电导率发生了明显变化(图11c2)。值得注意的是,即使在20°C的固体中,离子电导率仍保持9.6×10−4 S cm−1。它们在低温下的离子电导率符合Arrhenius模型,这表明电解质中的离子传输通过跳跃机制与溶剂分子的长程运动发生。尽管在这项工作中开发的电解质具有高低温极限,但足以证明特殊的溶剂分子设计可以使电解质的操作温度范围与其物理状态脱钩。
目前,虽然对电解质固化机理的研究还很少见,但可以肯定的是,电解质的固化过程也受到“四边形”相互作用的调节,特别是离子-离子和溶剂-溶剂相互作用的相对强度。因此,通过调节四种关系来实现非均匀凝固或设计离子电导率对相变不敏感的电解质是低温电解质未来发展的一个可能方向。
3.3 电解质加压是未来的机会
作为物质固有的热力学性质,电解质的冰点不仅与温度有关,还受环境条件(如压力)的影响。以典型的水电解质为例,水冻结成冰的过程是水团簇从四面体配位结构过渡到堆叠的六边形序列,伴随着体积的明显增加。因此,通过刚性空间限制效应(即增加压力)限制体积膨胀,可以降低水电解质的冰点。如图12a所示,类石墨烯通道内的单层水表现出丰富的相行为,对温度和范德华压力高度敏感。虽然没有明确的函数关系,但水的典型相变温度(从液体到六边形)随着压力的增加而显著降低。
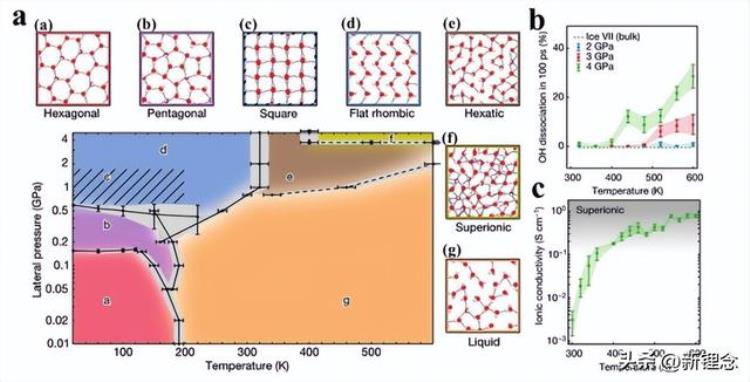
图12 通过改变压力设计低温电解质。a)单层纳米承压水相图。b)在2GPa、3GPa和4GPa下,单层(圆圈)和大块(虚线)水中游离OH键百分比的温度依赖性为100ps。c)单层水在4GPa下的温度依赖性离子电导率。灰色区域表示超离子状态的到来。
随着压力的增加,由于单层水中的O–O距离,水分子的解离程度显著增加(图12b)。然而,O–O距离调节质子转移势垒,导致质子快速扩散通过氧晶格。离子传导温度的函数表明,单层水可以转化为超离子导体(图12c)。
因此,通过空间约束实现高压状态的电解质有利于获得低冰点和较高的离子电导率。此外,纳米通道中的纳米级水表现出异常低的介电常数和近乎无摩擦的水流。纳米承压水由于其独特的财产,可用于电解质材料,表现出快速水流。此外还发现,限制在亚纳米环境中的有机电解质具有异常的财产,例如高沸点、高离子电导率和扩展的电化学稳定窗口。目前,高压纳米约束电解质很少用于低温电解质的开发,但其独特的性能使其非常有前景。
结论
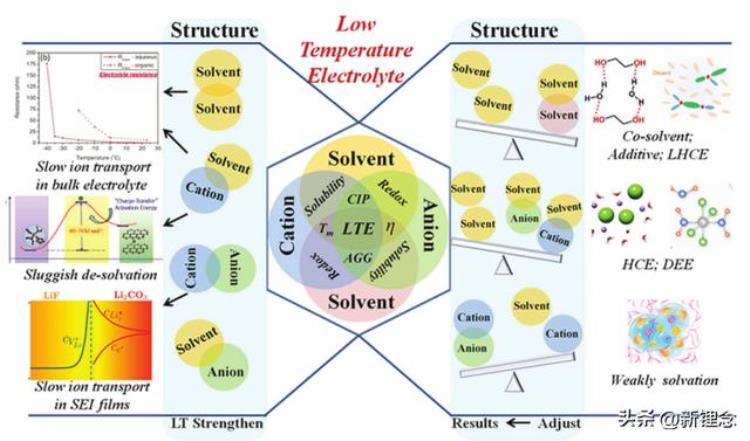
图13 对低温电解质的基本相互作用及其优化策略的原子见解。低温电解质的慢离子传输过程,包括散装电解质中的慢离子迁移、缓慢脱溶剂化和SEI膜中的慢电子迁移。低温电解质的设计策略,包括共溶剂、添加剂和弱溶剂化电解质
低温电解质的设计一直被认为是构建在极端低温下运行的高性能储能电池的关键技术,这对于实际应用具有重要意义。如图13所示,在这篇综述中,我们从原子水平的基本相互作用(包括阳离子-阴离子、阳离子-溶剂、阴离子-溶剂和溶剂-溶剂相互作用)分析了限制液体电解质低温性能的内部原因。然后,总结了低温电解质的设计策略及其核心机理深入分析。最后,创造性地指出了低温电解质今后的发展方向。尽管在低温设计方面做出了努力,但该领域仍面临许多挑战。
1.基本相互作用的系统研究。正如文章所指出的,低温电解质设计的关键是平衡四种基本相互作用。然而,目前对电解质的研究只关注一种或两种相互作用,而不是对所有四种相互作用及其配位的系统研究。因此,为了更全面地分析电解质结构并找到低温电解质设计的一般机制,应更系统地研究基本相互作用。通过大量的定性和半定量系统研究,拟合出更准确的基本相互作用的函数关系,必将对低温电解质的设计具有深远的指导意义。
2.界面离子传输。电化学储能过程的本质是电解质和电极之间的离子传输,这与离子溶剂化结构和固体界面有关。然而,固体界面的复杂成分和令人困惑的脱溶过程使得储能机理的研究极具挑战性。在低温操作条件下,离子传输过程变得更加困难和复杂。因此,在低温下的强溶剂-溶剂相互作用下,分析电解质衍生的SEI的一般规律,研究界面脱溶剂化机理,阐明界面离子扩散机制,对于提高电池的低温性能具有重要意义。
3.电解质的固化机理。在低温下,粘度的增加和电解质的固化是其失效的主要原因。然而,低温下电解质的结构演变仍不清楚。事实上,是什么决定了纯溶剂的冰点仍然是一个未解之谜。此外,对于电解质而言,强离子与溶剂的相互作用将使这一问题的揭示更具挑战性。此外,在电池中,电解质几乎与电池中的所有部件接触,包括电极、隔板和电池壳。因此,电池电解液在低温下的凝固过程涉及非均匀成核,这将加剧问题的复杂性。尽管这非常具有挑战性,但澄清电解质的凝固机制是解决低温下电解质失效问题的根本策略。
4.结构-性能关系。结构决定性能是材料科学中一个毋庸置疑的真理,这也适用于电解质研究。然而,与具有有序结构的材料不同,电解质的结构是短程有序和长程无序的,这不利于从结构表征的角度研究其性能。尽管溶剂化结构对于描述电解质的结构非常有用,但它仍然是一个忽略溶剂-溶剂相互作用和其他更复杂的诱导力的理想模型。因此,溶剂化结构不能准确描述电解质的结构,更不能预测性能,尤其是对于具有强溶剂的低温电解质-溶剂相互作用。目前,对电解质结构的描述仍停留在定性的四种相互作用上。需要更准确和通用的电解质结构模型,以更好地定义电解质的结构-性能关系。
参考文献
Atomic Insights into Advances and Issues in Low-Temperature Electrolytes.Ruilin Hou, Shaohua Guo* ,Haoshen Zhou.Advanced Energy Materials.2023.
原文链接:
https://onlinelibrary.wiley.com/doi/abs/10.1002/aenm.202300053

文章评论