Biacore检测蛋白与小分子相互作用的常见问题上
不管是在药物研发还是基础科研中,检测蛋白与小分子的相互作用都是一类重要的实验。小分子最主要的特点是分子量较小,一般在1000 Da以下;并且结构性质各异,部分溶解度较差,需要使用有机溶剂(例如DMSO等)促溶;这些特点给相互作用的检测带来很大的挑战。基于SPR(表面等离子体共振)原理的Biacore系统具有灵敏度高、可进行溶剂校正等优势,不仅可以检测较低的信号,且对分子量差异悬殊的互作类型也能精确检测,同时还能消除有机溶剂带来的影响,因此越来越多的研究者选择Biacore进行蛋白与小分子相互作用检测。
我们将根据智荟专线收集到的客户反馈,针对Biacore系统检测蛋白与小分子相互作用实验中常出现的代表性问题,分上下两篇进行简单的分享与讨论。本篇为上篇,将主要围绕实验设计和样品准备方面的问题展开介绍。
一
配体的固定策略以及芯片的选择
对于配体(固定相)采用合理的固定方式并达到所需的固定量,是Biacore实验迈向成功的第一步。然而所有基于传感器表面的检测技术,都会面临“物质迁移效应”的影响,所以根据实验类型及科学的偶联量计算公式去控制偶联量非常关键。为此,目前仅有Biacore具备这样严谨的计算公式,这其中固定量的计算方式主要就是参考以下核心方程式,并且其不仅适用于直接偶联法的偶联量计算,也可用于捕获法的捕获量计算:

公式中,RL为配体的固定量,Rmax为芯片表面的最大结合容量,Sm为化学计量比(未知情况时可先设为1)。此公式可以简单理解为,Biacore中产生的响应值信号反映的是芯片表面质量的变化。一般情况下,对于动力学分析,要求Rmax ≤ 50 RU;对于亲和力分析,要求Rmax ≤ 100 RU。由此计算得到理论固定量RL,在偶联法中实际固定量可能需要1.5~3RL;在捕获法中,则可以按照理论固定量来设定配体的捕获量,因为捕获过程的分子朝向固定,条件一般也是温和的接近中性,最大程度地保留的配体分子的活性。
对于上面的核心方程式有了基本的了解之后,就可以回答下面这些问题了。
1
是选择固定蛋白还是固定小分子?
首先需要明确的是,如果您的实验目的是想获得精确的亲和力数值,那建议选择固定蛋白。考虑到小分子的固定难度、空间位阻以及固定过程对于结合的影响等方面的问题,选择氨基偶联的方式固定蛋白往往是最简单、有效的固定方式。而小分子本身的活性基团有限,基团的反应活性也与蛋白存在一定的差异,偶联条件需要摸索,另外,通过这些基团的偶联反应可能也破坏了小分子仅有的结合反应活性位点。因此,只有对于某些特定类型的定性实验,比如分子垂钓,固定小分子也是可行的,通常推荐的固定方式是使用SA芯片固定生物素修饰后的小分子,可以在比较明确的条件下实现稳定的固定,而且生物素分子在一定程度上可以起到间隔臂(spacer arm)的作用,减少小分子结合受到的空间位阻影响。
综上所述,固定蛋白的过程相对简单也适用于大多数结合反应,因此是目前探究蛋白与小分子互作时最常用的选择。
2
固定蛋白是选择直接偶联还是捕获法?
先说结论:我们建议,进行蛋白与小分子互作实验时优先考虑直接偶联蛋白的方式。
直接偶联(氨基偶联)法的操作方法较简便、明确,而且可以实现较高的偶联量,在小分子作为分析物时,有利于获得比较理想的响应值。例如常用的CM5芯片,最高偶联量可以到10000 – 15000 RU,非常适合蛋白与小分子此类分子量差异悬殊的检测。除了直接偶联法以外,根据样品性质与分子量差异,捕获法也是一种您可以选择的固定策略,例如:待固定的样品未经纯化,含有其他杂质;或者担心直接偶联的过程会影响结合位点等。在这些情况下,可以考虑通过捕获法固定配体。当配体样品的纯度不够时,捕获的过程相当于在芯片表面进行了一次在线纯化;捕获过程的条件较为温和,可以尽可能地保留配体的结合活性,同时保证配体自由朝向,充分暴露结合位点。
常用的捕获类芯片以NTA芯片为例,这是一种可以通过螯合镍离子捕获带有His标签蛋白的捕获芯片。如下图1所示,NTA芯片上捕获量大约在3000 – 4000 RU[1]最为稳定,非常适合His标签蛋白与小分子二者分子量差异不是特别大的亲和力检测。
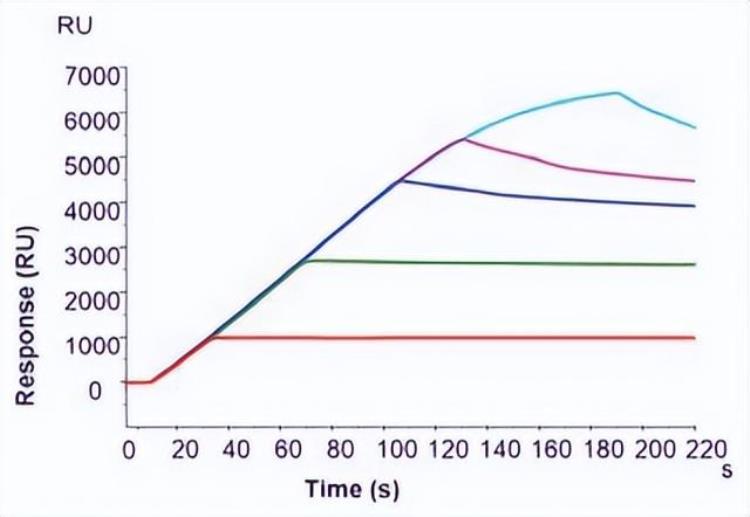
图1. 在NTA芯片上,不同捕获量水平下基线的稳定情况[1]。
3
氨基偶联蛋白配体是选择CM5芯片还是CM7芯片?
CM5与CM7芯片表面均为羧甲基化修饰的葡聚糖基质,两者最主要的区别是CM7芯片的羧基含量显著高于CM5芯片,因此可以实现更高的偶联量。图2比较了三对蛋白与小分子的互作在CM5和CM7芯片上的结果差异,可以看到同一组互作实验,在CM7芯片上可以达到的偶联量和分析物响应值为CM5芯片的3倍以上 [2] 。
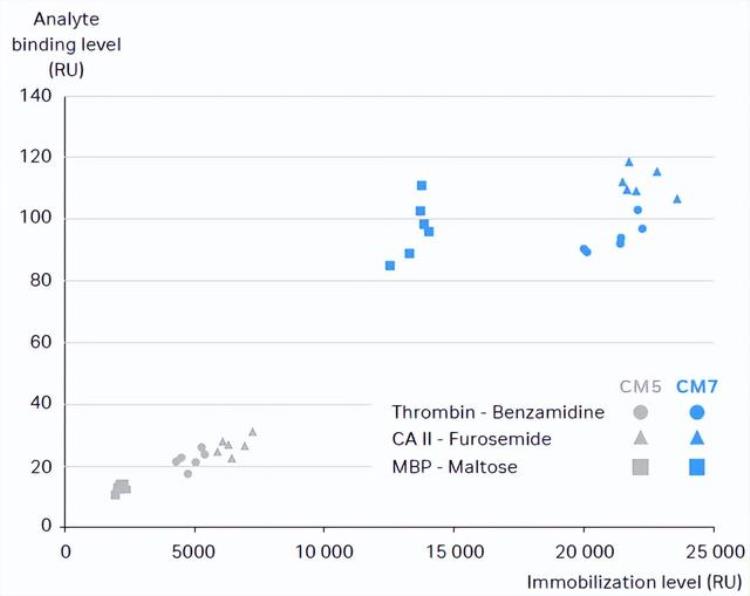
图2. 三组蛋白与小分子互作在CM5和CM7芯片上的偶联量与分析物响应值比较[2]。
如上所述,CM5芯片的最高偶联量在10000 – 15000 RU左右,如果按照固定量计算公式得到的理论偶联量远超这个范围,则可以考虑使用CM7芯片。简单来说,当蛋白与小分子的分子量比值大于100时,就建议考虑换用CM7芯片。
二
样品准备的相关问题
在确定了配体的固定策略,并选定了相应的芯片之后,就可以开始下一步的实验了。进入试剂、样品的准备阶段,又会遇到哪些问题呢?我们接着往下看。
1
如何选择运行缓冲液?
目前Cytiva供应的用于Biacore实验的运行缓冲液主要有两大类,分别是基于HEPES缓冲体系的HBS系列缓冲液与基于磷酸盐缓冲体系的PBS系列缓冲液。
在选择运行缓冲液时,并没有明确的规定必须使用何种缓冲液,应该根据分子互作的自身性质选择合适的缓冲液。一般来说,有以下经验可供参考:当分析物是小分子的情况下可以首先尝试PBS 或者PBS-P 缓冲液;而分析物为蛋白时可以首先尝试HBS或者HBS-EP 缓冲液。
在一些情况下,小分子的溶解需要一定浓度的有机溶剂助溶,例如5% DMSO等,而这些有机溶剂在不同样品之间的浓度差异会干扰响应值信号,因此需要对这部分由运行缓冲液造成的信号进行校正——溶剂校正。而有机溶剂自动校正的功能,也是Biacore的绝活儿之一,充分保证了最终实验结果真实可信。关于溶剂校正的相关问题将在下篇中进行讨论。
2
需要准备多少的蛋白用来偶联?
实验准备的配体蛋白量,至少要足够其达到所需的偶联量。下表展示了要达到不同的偶联水平时所需的配体浓度以及相应的配体偶联时间(流速为10 μL/min),可供参考[3]。需要注意的是,表中列出的“配体工作浓度”是用偶联缓冲液醋酸钠稀释配体蛋白样品后的浓度。为了让稀释后的蛋白样品能够充分富集在芯片表面,醋酸钠的稀释倍数一般要在20倍以上;如果稀释倍数不够,将影响配体蛋白偶联效率。因此,准备配体蛋白母液时最好在工作浓度的20倍以上。
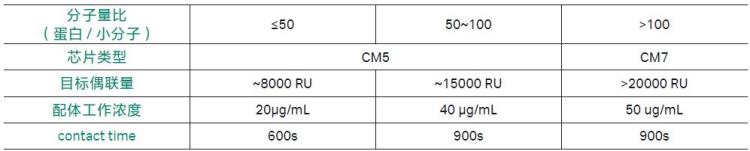
表1. 偶联量与配体工作浓度参考表[3]。
对于一个未知的实验,摸索合适的偶联量等过程是必不可少的,因此对于蛋白配体的用量也不应仅限于够一次偶联实验使用。一般的建议是,配体蛋白的准备量在1 mg/mL浓度、50 μL以上。但即便如此,老师们也能清晰的算出来Biacore对于蛋白的用量非常低,远远优于您其他的互作检测手段。
3
小分子分析物的浓度范围如何确定?
不管在动力学(Kinetics)分析还是在亲和力(Affinity)分析中,分析物浓度范围的确定均与结合反应的解离平衡常数(KD)有关。一般设置的分析物浓度梯度范围如果能够覆盖KD值,将会达到较准确的拟合结果。在动力学分析中,一个理想的分析物浓度范围可以从10 × KD作为最高浓度进行梯度稀释;在亲和力分析中,理想的分析物浓度范围可以选择从2 × KD的浓度作为最高浓度进行梯度稀释[4]。对于蛋白与小分子的互作,大多数情况下是“快结合快解离”的模式,适用于亲和力分析的模型(关于数据分析中模型选择的问题,将会在下篇中进行讨论)。蛋白与小分子结合反应的KD值,基本都在μM级别,因此可以将小分子最高浓度设为1000 μM,按照3倍甚至5倍的稀释比例来配制浓度梯度(拉大范围)。进行这样的初步实验后,基本可以确定反应KD值的大致范围,后续可以调整浓度范围、减小稀释比例再进行进一步实验。当然,小分子能够达到的最高浓度还受到溶解度等因素的影响。
以上是针对Biacore检测蛋白与小分子互作的实验方案设计以及样品准备方面的常见问题分享。良好的开端是成功的一半,合理的活性配体偶联量、分析物浓度范围以及运行缓冲液选择,将帮助我们得到更理想的实验结果。在下篇中我们将继续分享关于实验进行以及数据分析方面的常见问题,敬请期待!
文末的二维码中为大家准备了检测蛋白与小分子结合的SOP,Biacore芯片与耗材选择指南,以及两篇相关的应用指南,欢迎大家扫码下载。
参考文献:
[1] Series S Sensor Chip NTA Instructions for Use, 22060737 AI V:8 07/2020.
[2] Sensor Chip CM7 Series S Sensor Chip CM7, CY14426-10Sep20-DF.
[3] Easy Biacore: T200 检测蛋白与小分子结合.
[4] Kinetics and affinity measurements with Biacore systems, CY12854-21Jan21-HB.

文章评论