国外的疫苗研发凭什么比中国快「国外的疫苗研发凭什么比中国快」
图自网络
消息一出,大家都震惊了:新冠病毒明明首先是在中国被发现、被研究的,之前的报道也说中国疫苗研究进展迅速,为什么现在外国的疫苗啪地一下就出来了,很快呀!发生肾么事了?疫苗进化史抛开政策因素,疫苗主要还是各国之间科技水平的较量。美、德后发先至的原因之一,在于他们选择了
2020年11月18日,美国Pfizer与德国BioNTech公司公布了他们联合开发的mRNA新冠疫苗的三期临床试验结果,保护效率高达95%,该疫苗成为世界上首个完成三期临床试验的新冠候选疫苗,随后率先开始推广接种。
图自网络
消息一出,大家都震惊了:新冠病毒明明首先是在中国被发现、被研究的,之前的报道也说中国疫苗研究进展迅速,为什么现在外国的疫苗啪地一下就出来了,很快呀!发生肾么事了?
疫苗进化史抛开政策因素,疫苗主要还是各国之间科技水平的较量。美、德后发先至的原因之一,在于他们选择了最新的疫苗类型——mRNA疫苗。
如果我们把人体比作城市、把病毒感染比作老鼠泛滥成灾,那么疫苗引起人体免疫反应的过程,就是让从来没有老鼠的城市做好应对鼠灾的准备。
那要如何让这座城市里从未见过老鼠的人认识老鼠,从而在老鼠刚刚出现时就进行捕杀呢?有以下几种办法:
抓几只松鼠给他们看闹鼠灾的是老鼠。最开始技术有限,还抓不到老鼠,只能抓几只松鼠。反正都叫“鼠”,长得还有点像,人们看过了松鼠,四舍五入就认识了老鼠。
人类历史上第一个疫苗就是这样,拿感染其他的动物的类似病原体作为人的疫苗,即异型疫苗。1796年,爱德华·詹纳发明了牛痘,也就是用感染牛的天花病毒来引起人体的免疫反应。他率先用已接种牛痘的人身上取痘苗转接,拓宽了痘苗的来源,首次用疫苗防止了天花的大规模传染,最终让人类在与传染病的战争中第一次获得了胜利。
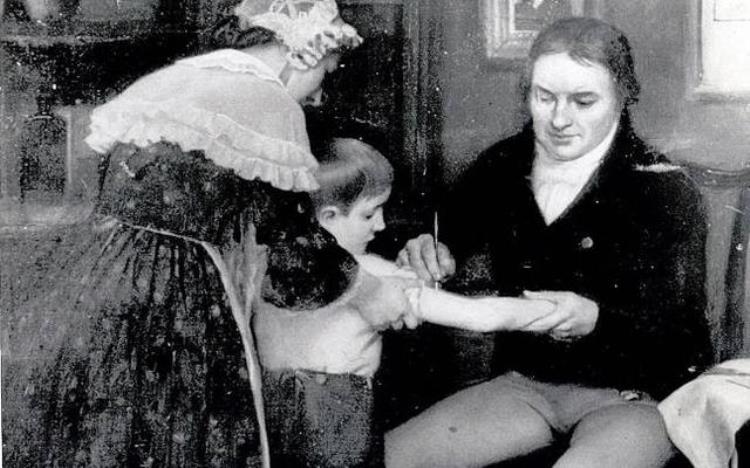
爱德华·詹纳正在给孩子接种牛痘 | 图自网络
抓几只完整的老鼠给他们看完整的老鼠能让人全面地记住老鼠的特点。但是,如果直接抓了活蹦乱跳的老鼠过来,很容易失控,反而将鼠灾直接引入。所以,需要把老鼠弄得半死不活,或者杀死,再进行呈现。这分别对应着减毒活疫苗和灭活疫苗。
1880年,巴斯德发现,将导致鸡瘟的病菌在实验室内培养一段时间后,毒性会降低,但是注射回鸡的体内后能大大增强其免疫力。鸡瘟疫苗成为了人类历史上第一种在实验室里制备出来的疫苗。
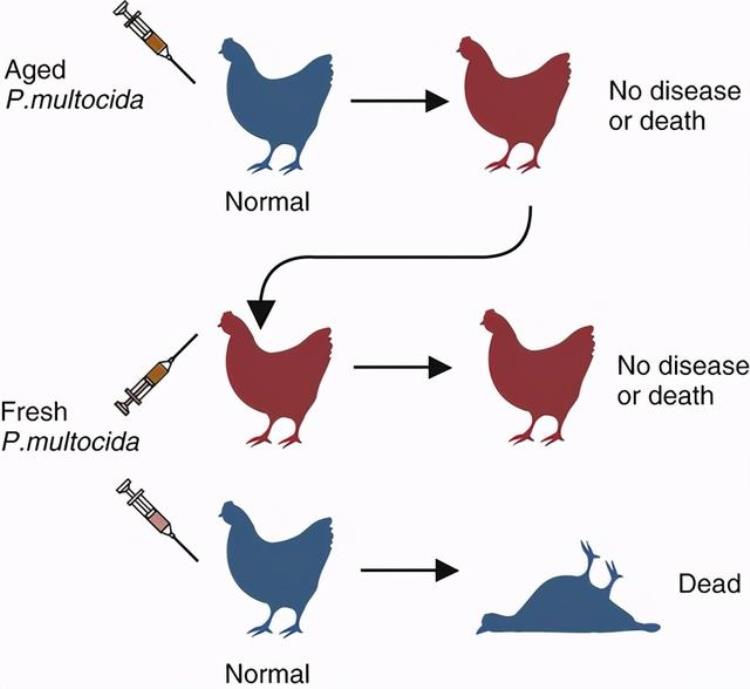
鸡瘟疫苗研究过程 | 图自网络
减毒活疫苗和灭活疫苗技术成熟,安全性高,至今仍被广泛使用,比如中国已经开始推广接种的新冠疫苗就是灭活疫苗,但是它们存在缺点。制备减毒活疫苗通常需要对病毒进行漫长的传代培养,才能将病毒活性降至安全水平。灭活疫苗相对容易制备,直接杀死即可,但这样又会丢失掉一些活病毒的性质,其免疫效果相对没那么好。
将老鼠的部分部位给他们看完整的老鼠就算奄奄一息也还是存在存活、逃脱的风险。如果只拿来一条老鼠尾巴或一张老鼠皮,就安全得多了。
细长的尾巴是老鼠的标志性特征,人们先认识了老鼠的尾巴,再见到完整的老鼠时,就能凭借这一特点将这种有害动物识别出来。病毒感染人体和引起免疫反应的关键成分是蛋白质。将病原体的部分关键蛋白,通过基因工程大量生产出来,注入体内,就可供免疫系统识别、产生记忆,这就是亚单位疫苗。
老鼠尾巴还不容易看清,老鼠皮更接近老鼠的真实形态。病毒样颗粒就是病毒的空壳,比起单个蛋白,含有更多的病原体信息,能更好地引起免疫反应。
送一幅画着老鼠的画给他们看要认识老鼠,不必看到实体的老鼠,去观察一幅画着老鼠的画就行了。
那么对于生物体而言,画着病原体结构的画是什么呢?
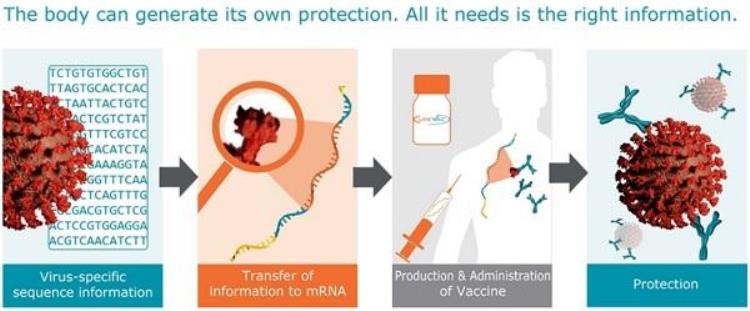
mRNA:制造蛋白质的图纸先来复习一下中心法则:
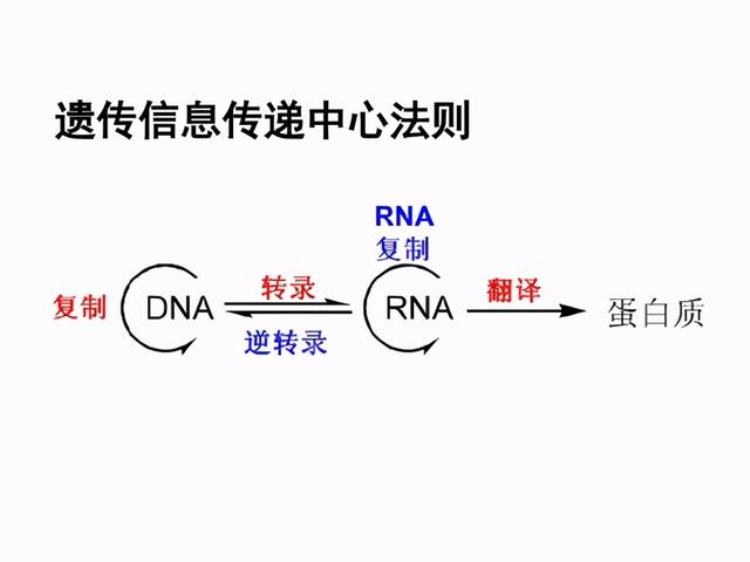
蛋白质是生命活动的主要执行者,也就是会造成实际后果的实体老鼠。
而核酸(包括DNA和RNA),就是制造蛋白质的图纸,也就是那幅画着老鼠的画。DNA是底本,需要经过“复印”才能间接指导蛋白质的合成。mRNA则能直接指导翻译。
mRNA疫苗:成熟的细胞要学会自己制造抗原!将含有病毒信息的核酸注入机体,细胞就会依据图纸制造出来自病毒的蛋白质,作为抗原,供免疫系统识别和记忆。这就是核酸疫苗。
实际上,这与亚单位疫苗一样,本质上还是以病毒的部分蛋白作为抗原,不同之处在于制造病毒蛋白的是体外培养的基因工程细胞,还是人体自己的细胞。体外培养细胞制造蛋白,需要进行纯化等步骤,时间长、成本高,容易含有杂质而造成过敏。而人体自己制造蛋白,就不存在这些问题,能快速产生专一的免疫反应。
核酸疫苗可分为DNA疫苗和mRNA疫苗。DNA比RNA更稳定,但是DNA需要先转录成RNA才能指导蛋白质的合成,而DNA要进入细胞核才能转录,但要使DNA穿过细胞膜后再穿过核膜,可不容易。其次,入核的病毒DNA可能会整合到细胞的基因组上,引起癌症等疾病!所以DNA疫苗的应用有很多困难。
mRNA疫苗则省去了入核和转录步骤,直接快进到翻译,用mRNA来直接指导细胞合成病毒的关键蛋白。
图自Curevac
比起其他种类的传统疫苗,mRNA疫苗具有以下优势:
快速研发生产应用最广、技术最成熟的减毒疫苗或灭活疫苗,都需要拿到真正的病毒才能开始研发。而mRNA疫苗,理论上只需要知道病毒的基因序列,就能开始制造——这就是美、德后发先至的关键原因之一!
中国科学家率先发现了新冠病毒,第一时间将病毒的基因序列与全世界共享。大洋彼岸当时还没有发现新冠病例的国家,虽然还没拿到病毒,但是有了基因数据,就可以直接进入疫苗研发程序,所以他们其实早就开始研究疫苗、投入临床实验了。
除了起跑得早,mRNA疫苗的研究流程所需时间本身就大大少于传统疫苗。传统的疫苗研发需要至少几年甚至十几年,mRNA疫苗一两个月甚至几个星期就能开始临床实验。再加上疫情紧急,政策、资金一路开绿灯,mRNA疫苗的研发速度优势得以淋漓尽致地展现出来。
理论上更安全理论上,mRNA的免疫原性较弱,不像DNA那样可能被整合进基因组,而且具有较短的半衰期,机体不会长期合成病毒的蛋白质而造成不良后果。(注意只是理论上!)
稳定纯度高的RNA,其实也没有大家通常认为的那样脆弱,还是具有相当的稳定性的。再经过一些序列、结构的优化和化学修饰,稳定性进一步提升。注入机体后一段时间内,蛋白表达动力学可以保持稳定一致。
应用范围广mRNA疫苗能靶向细胞内或细胞外的各种靶点。
以上优点主要是基于前期研究和理论预测,实际上mRNA疫苗还有很多问题:
免疫原性问题我们希望机体对病原体产生免疫反应,而不是针对疫苗本身的免疫原性产生反应。
mRNA的免疫原性通常不像蛋白质那么强,但也并不是完全没有免疫原性。细胞可能误认为mRNA疫苗是病毒(因为由很多病毒的遗传物质是RNA),从而激活固有免疫。国外接种新冠mRNA疫苗后引起的过敏等不良反应,有可能就是因此而起。
恰当的修饰可以降低mRNA本身的免疫原性。
递送问题mRNA需要穿过一层细胞膜,到达细胞质内,才能进行翻译。裸露的RNA无靶向,递送效果不好,而且不稳定、易降解。需要对RNA进行适当的包装,促进mRNA进入细胞。
现在主要的RNA药物递送平台是脂纳米颗粒(lipid nanoparticle),稳定性高,且具有靶向。但是,脂质体具有一定毒性,不宜大量注入人体。需要通过成熟的技术,降低疫苗的有效剂量,减少注射次数,来降低疫苗的毒性。
制备问题大量制备mRNA也是一个挑战。
稳定性问题RNA毕竟不如DNA或者灭活病毒那么稳定,所以我们看到现在美国的疫苗需要很严苛的储存条件(较长期储存需要零下负80摄氏度),因此需要各种特殊设备,也只能在条件较好的发达国家用用了,大规模推广基本不现实。而中国研制的灭活疫苗储存条件宽松,保质期长,发展中国家和相对不发达的地区也能用得起。
增加mRNA稳定性的优化方法还需要更多的探索。
新冠疫苗:机遇与挑战除了前文提到的Pfizer和BioNTech,Morderna、Arcturus/Duke-NUS、Curevac等公司/团队也在研究mRNA疫苗。Morderna公司的新冠mRNA疫苗也已经通过批准,开始接种。
mRNA疫苗是最新的疫苗种类,新冠mRNA疫苗成为了人类历史上首次大规模应用的mRNA疫苗。
mRNA疫苗在国外已经得到了长久的关注和发展。国外能抢先完成三期临床,也不仅是靠选择了研发快速的疫苗种类,更重要的是因为他们已经积累了相对成熟的技术,是训练有素,有备而来。
我们大意了啊,没有闪,在国内,mRNA疫苗和药物的研究才刚刚起步,少为人知,技术也不成熟,所以新冠疫苗中首先研发、广受关注的国产疫苗都还是传统的类型。复旦大学林金钟老师的团队正在研究mRNA疫苗,并取得了突破。
mRNA疫苗免疫效果的关键之一,在于选择编码合适的病毒蛋白作为抗原。在研的其他mRNA疫苗大都选择了编码新冠病毒的Spike蛋白。而林老师的团队创新地用mRNA编码新冠病毒的三种包膜蛋白S、M、E,表达出新冠病毒样颗粒,在小鼠体内能诱导产生最强的特异专一的免疫反应。这也是全世界首个使用mRNA技术进行体内表达新冠病毒样颗粒,并且完成概念疫苗验证的研究。
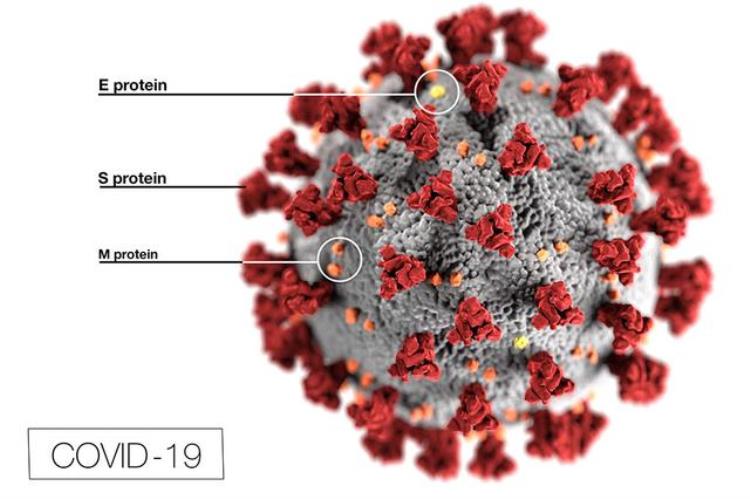
三种包膜蛋白示意图,S protein即Spike蛋白 | 图自网络
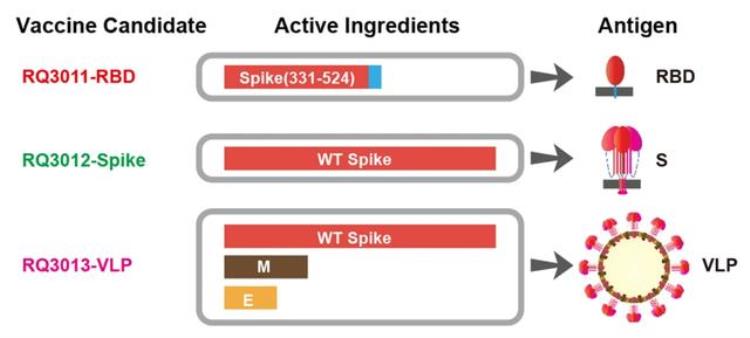
团队制备了分别编码部分S、全长S和S、M、E组成的病毒样颗粒的mRNA疫苗来筛选 | Lin et al. Cell Res, 2020
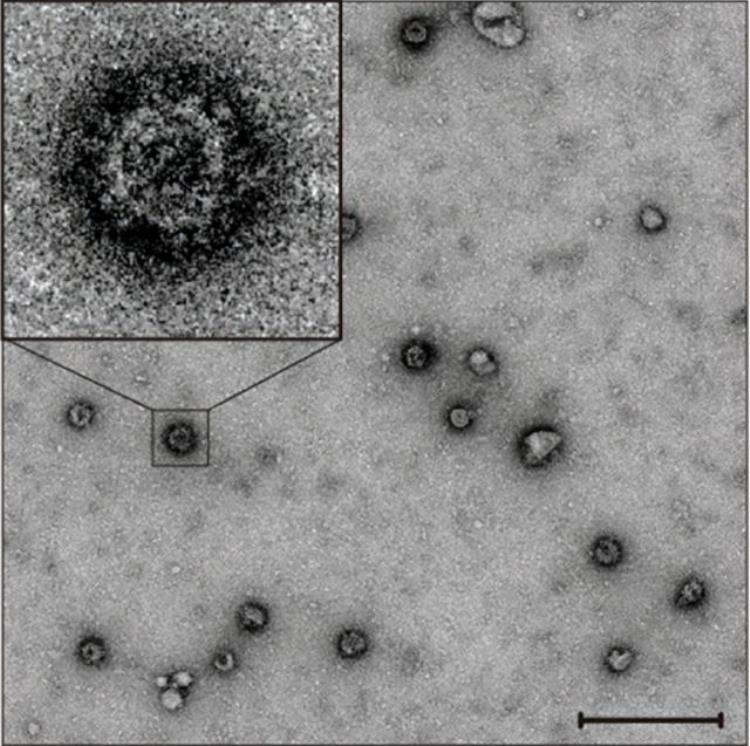
mRNA疫苗表达的病毒样颗粒电镜图 | Lin et al. Cell Res, 2020
我国在新冠疫苗研发中选择了稳妥的方式,即以传统的、安全性有保证的灭活疫苗为先,mRNA疫苗等新型疫苗为辅。现在我们看到国外的mRNA疫苗虽然保护性较好,但出现了很多不良反应;我国疫苗的保护性稍微差一些,但足够安全。这证明国家的战略十分正确,同时我们也不能一棒子打死mRNA疫苗,毕竟可能只是目前的技术水平不够(国外的两个mRNA疫苗的研发确实是太赶了),而不是mRNA疫苗本身存在缺陷。我们还需要更多的研究、更多的证据,来判断现有mRNA疫苗的安全性问题出在哪里、如何解决,以及mRNA疫苗究竟是否可行。
另一方面,我国在mRNA疫苗领域确实落于下风。不仅基础科研有差距,甚至 “mRNA体外合成核心原料基本全部依赖进口”,“mRNA生产工艺和药物制剂工艺缺乏”,容易被国外卡脖子。如今国外研究mRNA新冠疫苗的消息,或许会掀起国内研究mRNA疫苗的热潮,这是我们发展相关科技的大好机遇,同时也是对我们科研水平的挑战。
mRNA药物:表达任何蛋白,治疗任何疾病?将目光放得更广阔长远,mRNA的用途远不仅局限于传染病疫苗,还可以开辟药物发展的新天地。
有明确成分和机理的药物,主要分为小分子药物、蛋白质药物和核酸类药物三个阶段/种类。小分子药物主要靶向蛋白质,研发周期长,而且对很多致病位点无能为力。蛋白质药物功能丰富,但同亚单位疫苗和腺病毒载体疫苗类似,面临着免疫原性难以控制、生产工艺复杂,不能进入细胞靶向细胞内靶点等问题。核酸类药物则作用方式丰富,疗效显著,将是未来药物研发的新方向。

图自网络
mRNA药物是基于这样的思路:很多疾病是由于机体缺乏某种重要的蛋白质造成的,将这种蛋白补充上,机体就能恢复正常。使用mRNA药物,导入的是mRNA,发挥疗效的是其编码的蛋白质。
图自网络
已有mRNA药物应用于关节炎等疾病的治疗,此外还有很多处于临床实验阶段。
有科学家信心十足地说:我们可以用mRNA表达任何蛋白质,治疗任何疾病!这句话未必完全正确,但能给我们展示一个美好的未来,激励我们不断钻研探索。
本文主要根据林金钟老师相关讲座的内容,结合《生物化学》《感染与免疫》等课程的知识整理而成。
其他参考资料:
1.https://mp.weixin.qq.com/s/oTjuAsfvLfEruHA-nY2clA
2.Draft landscape of COVID-19 candidate vaccines. WTO, 12 November 2020.
3.https://mp.weixin.qq.com/s/21xuO565eTX1A2I1A5PsRQ
4.Lu, J., Lu, G., Tan, S. et al. A COVID-19 mRNA vaccine encoding SARS-CoV-2 virus-like particles induces a strong antiviral-like immune response in mice. Cell Res 30, 936–939 (2020). https://doi.org/10.1038/s41422-020-00392-7
莫迪称印度制造新冠疫苗将很快问世,为何比中国快?
印度也在这一关键时刻突然宣布了其疫苗研发进展,这令整个世界感到惊讶。莫迪在8月15日印度独立日宣布,印度有三种候选疫苗,它们都处于不同的测试阶段。"一旦我们的科学家给予许可,印度制造的COVID-19疫苗将很快问世."
毫无疑问,这一声明将极大地激发印度人民的民族自豪感和荣誉感,这也是莫迪在独立日公布疫苗进展的主要原因。在边境冲突中遭受重创后,莫迪政府一直在想方设法团结各种力量,激励人民。可以说,“印度疫苗研制成功”的消息来得非常及时。
然而,印度还没有听说它在生化技术领域积累了多深。为什么这么快?
首先,可能是印度卫生部谎报了指标,以便在独立日送一份节日礼物,这样莫迪会有更多的面子。因此,不能排除这是出于政治目的故意夸大的结果。毕竟,在这个国家发展坦克和战斗机需要30到40年的时间,夸大其词是政客们的日常操作。
其次,另一种可能性是,印度已经从其他国家获得了疫苗数据,并立即发挥其超强的生产复制药物的能力,分批进行不同疫苗的动物和人类试验。我们从莫迪那里知道,印度应该至少复制了三个疫苗样本。
然而,问题是,尽管这些疫苗数据可以通过世界卫生组织的数据库公开查询和下载,但许多国家的疫苗都是首先根据本国民族的基因数据开发的,只有中国在许多大洲开展了人体试验,以实现其全球共享的承诺。因此,在最终确定之前,这些复制疫苗对印度人是否有效仍需要在两到三次人体临床试验中观察。
那么,也就是说,莫迪号称印度可以快速生产疫苗的承诺,应该是有很大水分的——临床试验都需要好几个月,何况还要大量生产。事实上,印度制药行业的原料严重依赖中国,甚至没有达标的疫苗生产线,连疫苗玻璃瓶都要从中国进口.
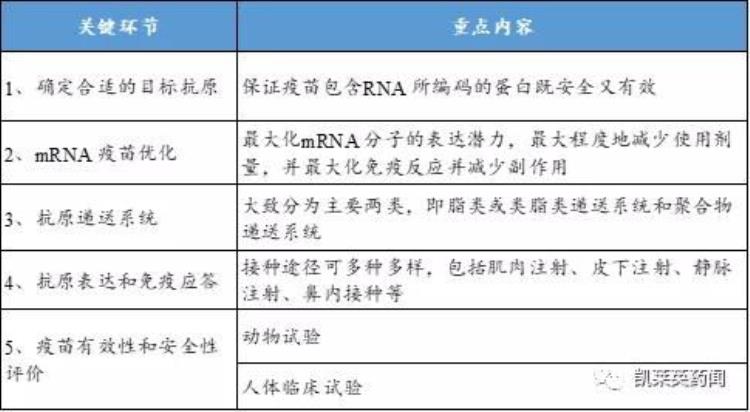
细说mRNA疫苗:为何新冠疫苗的研发速度是史上最快的?
新冠疫苗研发史上最快,为什么这么快呢?我认为主要有以下六方面因素。
首先,疫情控制的迫切需要。到8月12日,全球报告新冠肺炎病例超过2000万例,死亡病例接近74万例,波及200多个国家或地区,花费了全球的大量医疗资源,影响到了社会和经济的发展。
其次,新冠各种研究信息快速得到共享。作为新发传染病,病原学、临床学、流行病学、疫苗学等相关研究不但进展快,而且能够通过网络全球快速共享,为疫苗快速研发奠定了基础。例如,我国在第一时间与全球共享了新冠病毒的全基因组序列,这使得新技术基因重组疫苗得以快速构建;从致病机理,很快掌握新冠病毒侵犯途径是ACE2受体,确定了疫苗研究的靶点等。
再次,新技术成熟的平台使得疫苗研发能够快速推进。此轮疫苗研发除了采用传统的灭活疫苗、减毒活疫苗技术以外,还采用了基因重组的人体外表达抗原技术(亚单位蛋白和病毒样颗粒)和人体内表达抗原的新技术(非复制和复制性病毒载体疫苗、DNA疫苗和mRNA疫苗)。
第四,疫苗中试和规模化生产的技术和工艺相对成熟。因此,使得实验室培养和构建的疫苗株,能很快生产出来,投入临床前研究和临床试验研究。
第五,监管部门开辟了绿色通道。各国在严控标准的基础上,及时出台相应规范,开辟了应急审评通道,使得临床一、二、三期快速推进。
第六,双方或多方合作前所未有。为了做好疫苗研发快速、系统、规范推进,国际组织(WHO、流行病防范创新联盟、盖茨基金会等)、相关国家、企业、研究机构等开展了前所未有的合作。

文章评论