幽门螺杆菌疫苗上市时间「幽门螺旋杆菌疫苗折腾了17年为啥至今也未能上市」
自2000年起,“口服重组幽门螺旋杆菌疫苗”由第三军医大学与重庆康卫(现芜湖康卫)合作,共同开发。17年间,该疫苗从开始研发到完成临床试验、拿到新药证书,又再次回到批准临床,仍需进一步研究。一波三折,2004年已拿到临床批件1995年,第三军医大学组成课题组,正式进入胃病疫苗领域,并在2000年以技术入股的形式,与岳
(健康时报记者吴雨婷)日前,经国家食品药品监督总局审查,由芜湖康卫研发的“口服重组幽门螺旋杆菌疫苗”被批准临床,而这也是这个疫苗第二次拿到批准临床的审批件。
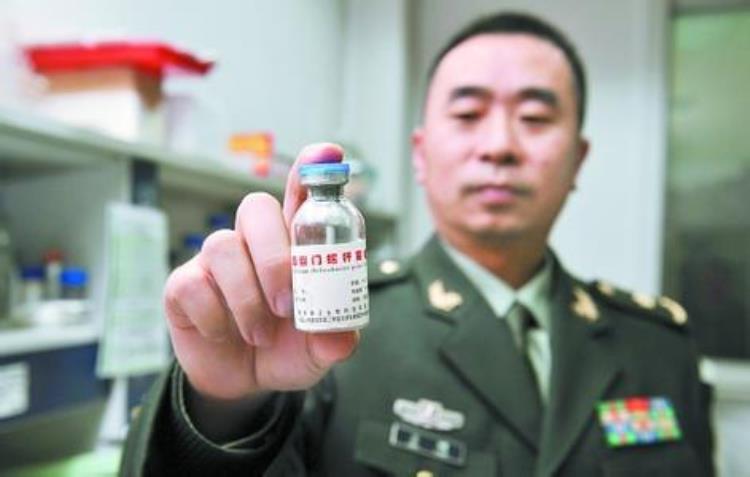
自2000年起,“口服重组幽门螺旋杆菌疫苗”由第三军医大学与重庆康卫(现芜湖康卫)合作,共同开发。17年间,该疫苗从开始研发到完成临床试验、拿到新药证书,又再次回到批准临床,仍需进一步研究。
一波三折,2004年已拿到临床批件1995年,第三军医大学组成课题组,正式进入胃病疫苗领域,并在2000年以技术入股的形式,与岳阳兴长和重庆市阳春生物科技有限责任公司合作成立重庆康卫,共同开发“口服重组幽门螺旋杆菌疫苗”。
“在我们国家,幽门螺旋杆菌的平均感染率能够达到50%,也就是说六七亿人都存在幽门螺旋杆菌的感染,这是一个非常庞大的数字。并且,它是导致消化性胃溃疡、慢性萎缩性胃炎、胃癌以及黏膜相关性淋巴样组织(malt)淋巴瘤的主要病因。”陆军总医院消化内科副主任李恕军介绍。
据悉,作为一种预防性的疫苗,凡是未被幽门螺旋杆菌感染的患者都可以服用该疫苗。不过,该疫苗仅是能够在一定程度上预防幽门螺旋杆菌感染,能否对疾病起到准确的预防作用还有待进一步研究。
2002年,芜湖康卫向国家食品药品监督管理局申报了产品“口服重组幽门螺旋杆菌疫苗”的临床申请,并且于2004年拿到临床批件,2007年完成该药的一系列临床试验。2009年4月23日,科技部宣布:芜湖康卫率先在世界上研制成功“口服重组幽门螺杆菌疫苗”,获得国家食品药品监督管理局批准颁发的一类新药证书。
2015年12月,芜湖康卫以补充申请的形式,提交了对于“口服重组幽门螺旋杆菌疫苗”上市生产批件申请。2016年2月16日,受理号CXSB1500012被国家食品药品监督管理总局药品审评中心承办。
2017年2月7日,岳阳兴长发布公告,该批件中的审批结论表述为:经审查,目前提供的数据不能充分证明拟上市批次产品与临床试验用样品可比,应进行临床试验证实拟上市产品的安全性、有效性;同时应一并考虑原新药证书批件中关于对后续临床研究的要求。
疫苗质量不可比,17年研发仍需努力一种疫苗或者新药的研发,通常是从实验室开始的。
“口服重组幽门螺旋杆菌疫苗”不仅在2009年就获得了新药证书,也曾获得“2013年度国家技术发明二等奖”。但是,不管是疫苗还是药品,要想走向市场,必须先做到产业化,并且批量生产出的疫苗要与临床试验的疫苗质量完全一致,才能保证其安全性和有效性。
因此,实验室得到的结果能否在工厂生产线上进行批量复制,在很大程度上决定了该药是否能够成功上市。而现实的情况是,拿到新药证书后,芜湖康卫的疫苗一直未能上市。
“如果企业前期工作充分,一般新药拿到证书之后1~2年也就能够拿到生产批件,工厂开始批量化生产。”北京鼎臣医药管理咨询中心创始人史立臣介绍说。
然而,历时七年,口服重组幽门螺旋杆菌疫苗的上市工作仍未完成。作为技术主要支持方的第三军医大学及其科研团队也在2013年正式退出疫苗项目。
此后,“口服重组幽门螺旋杆菌疫苗”的生产产地整体搬迁,生产工艺、设备、人员较2009年均发生了变化。负责生物疫苗审评的技术人员告诉记者,作为生物制品,疫苗的生产和质量控制强调生产工艺全过程控制,即使是某一步的微小差异也有可能被逐级放大,生产出完全不同的疫苗。
“药品审评中心是百姓用药安全的把关人。审评工作的目的不是为了增加疫苗上市的难度,而是保证我们市场上的每一种疫苗都是安全有效的。”据食品药品监督管理总局药品审评中心知情人士透露,由于产地转移及生产工艺变化等原因,芜湖康卫此次提交补充申请时的所用的“口服重组幽门螺旋杆菌疫苗”与2009年拿到新药证书的疫苗在质量特性、动物体内效价上都出现了不可忽视的差异,因此,按照国际通行技术指南,需要重新对产业化后的产品进行临床试验对其安全有效性进行进一步的验证。
编辑:步雯
大牌专家问诊、贴心健康提醒,尽在健康时报客户端。移步App Store和各大安卓市场下载,蓝色图标才是官方出品噢!

为什么国家没有生产幽门螺杆菌的疫苗?
才到3期,还没上市呢在863计划生物工程技术主题、“创新药物和中药现代化”重大科技专项的资助下,第三军医大学研制的口服重组幽门螺杆菌分子内佐剂疫苗取得了重要进展,于2004年12月3日获准进行Ⅲ期临床研究工作。该疫苗为目前国内惟一进入临床研究的幽门螺杆菌疫苗,也是国际上第一个获准进入Ⅲ期临床研究的幽门螺杆菌疫苗,有望成为世界上第一种幽门螺杆菌疫苗。
2002年7月,我国研制的口服重组幽门螺杆菌分子内佐剂疫苗完成药学、药理、毒理及中试等方面的临床前研究工作; 2003年5月19日获准进行Ⅰ、Ⅱ期临床研究;2004年6月已完成了Ⅰ、Ⅱ期临床研究,结果显示该疫苗安全性良好,具有显著的免疫应答效果。目前已经开始Ⅲ期临床研究,预计参与临床试验的人数达到10000人以上。
现阶段主要应用抗生素联合治疗Hp感染,但存在耐药性广泛、毒副反应大、易复发、医疗费用高,且不能最终彻底消灭Hp等缺点。目前,应用疫苗防治幽门螺杆菌感染是世界上幽门螺杆菌防治技术研究的热点。由于Hp疫苗可具有预防与辅助治疗的双重功效,因此市场前景广阔。
国家一类新药基因工程幽门螺旋杆菌疫苗(即胃病疫苗)000819
和乙型病毒性肝炎治疗性多肽研究项目600132
在第三军医大学通过了专家组的结题验收。第三军医大学邹全明教授率领课题组采用基因工程疫苗分子构建模式,成功建立了长期稳定的动物感染模型,克服了胃酸和胃蛋白酶对疫苗的破坏作用,提高了幽门螺旋杆菌疫苗的有效性和稳定性。吴玉章教授带领课题组完成了乙肝疫苗的先导结构筛选、优化和小试,圆满完成了中间试验和临床前评价的全部工作,获得了国家食品药品监管局颁发的临床研究批件。该疫苗是世界上第一个乙肝治疗性疫苗,是我国第一个脂质体冻干药品和我国第一个多肽疫苗。

文章评论